Фарбування по Граму - це експресний метод дослідження, що дозволяє встановити наявність бактерій в зразку і диференціювати їх як грампозитивні або грамнегативні. Метод заснований на хімічних і фізичних властивостях клітинної оболонки.[1] Метод Грама майже завжди застосовують в якості першого кроку при діагностицібактеріальних інфекцій .
Метод був запропонований датським вченимГ. К. Грамом, який розробив його в 1882 і опублікував в 1884 році, як спосіб, що дозволяє диференціювати подібні за симптомами бактеріальні інфекції: Streptococcus pneumoniae (пневмокок) і Klebsiella pneumoniae.[2]
Кроки
Частина1З 3:
Підготовка зразка
Частина1З 3:
 Приготуйтеся до роботи.одягніть рукавички і підв'яжіть довге волосся, щоб не забруднити досліджуваний зразок. Виберіть робоче місце під витяжкою або в іншому добре провітрюваному місці і продезінфікуйте його. Перш ніж приступити до роботи, перевірте, чи справні пальник Бунзена і оптичний мікроскоп.
Приготуйтеся до роботи.одягніть рукавички і підв'яжіть довге волосся, щоб не забруднити досліджуваний зразок. Виберіть робоче місце під витяжкою або в іншому добре провітрюваному місці і продезінфікуйте його. Перш ніж приступити до роботи, перевірте, чи справні пальник Бунзена і оптичний мікроскоп. Продезінфікуйте предметне скло.якщо предметне скло недостатньо чисте, вимийте його водою з милом, щоб видалити жир і бруд. Після цього продезінфікуйте його етанолом, очищувачем для скла або іншим способом, який прийнятий у вашій лабораторії.
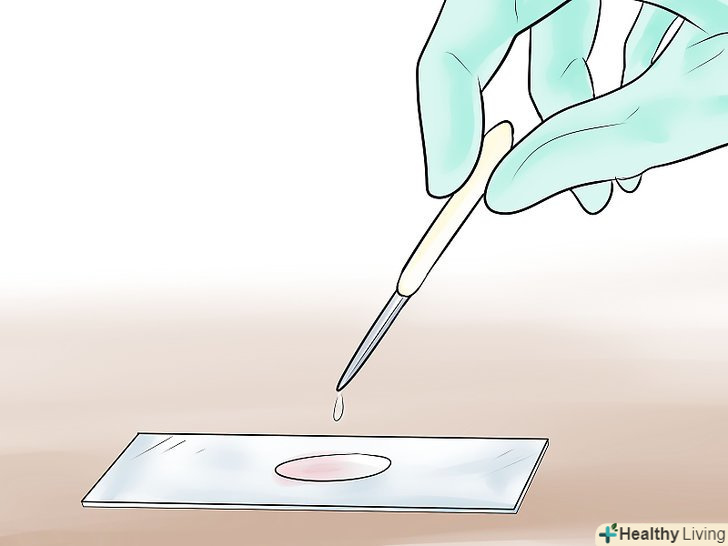
Продезінфікуйте предметне скло.якщо предметне скло недостатньо чисте, вимийте його водою з милом, щоб видалити жир і бруд. Після цього продезінфікуйте його етанолом, очищувачем для скла або іншим способом, який прийнятий у вашій лабораторії. Помістіть зразок на предметне скло.фарбування за Грамом дозволяє побачити окремі бактерії в медичних зразках або культури бактерій в чашці Петрі. Для початку нанесіть на предметне скло тонкий шар досліджуваної рідини. Рекомендується не витримувати зразок довше 24 годин, так як з часом у бактерій пошкоджуються клітинні стінки, і їх реакція на фарбування за Грамом стає менш передбачуваною.[3]
Помістіть зразок на предметне скло.фарбування за Грамом дозволяє побачити окремі бактерії в медичних зразках або культури бактерій в чашці Петрі. Для початку нанесіть на предметне скло тонкий шар досліджуваної рідини. Рекомендується не витримувати зразок довше 24 годин, так як з часом у бактерій пошкоджуються клітинні стінки, і їх реакція на фарбування за Грамом стає менш передбачуваною.[3]- Якщо ви досліджуєте зразок тканин, нанесіть на предметне скло 1-2 краплі. Розподіліть рідину тонким шаром по предметному склу за допомогою краю іншого чистого скла. Зачекайте, поки зразок висохне.
- Якщо ви фарбуєте бактерії з чашки Петрі, стерилізуйте бактеріологічну петлю в полум'я пальника Бунзена, поки вона не почне світитися, а потім дайте їй охолонути. Нанесіть петлею краплю стерилізованої води на скло, потім повторно стерилізують петлю, дайте їй охолонути, акуратно захопіть крихітний зразок культури бактерій і розчиніть його у воді.[4]
- Бактерії в живильному середовищі спочатку слід перемішати в вихровому змішувачі, а потім петлею перенести зразок на предметне скло без додавання води.[5]
- Якщо ви досліджуєте мазок, злегка притисніть його до предметного скла.[6]
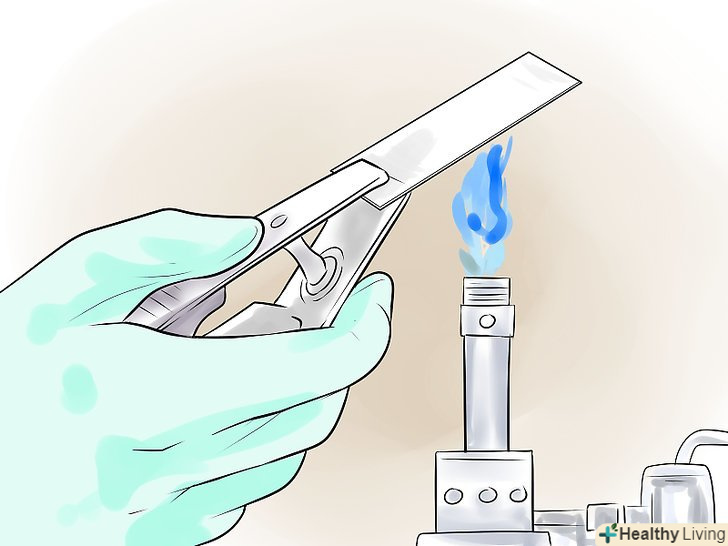
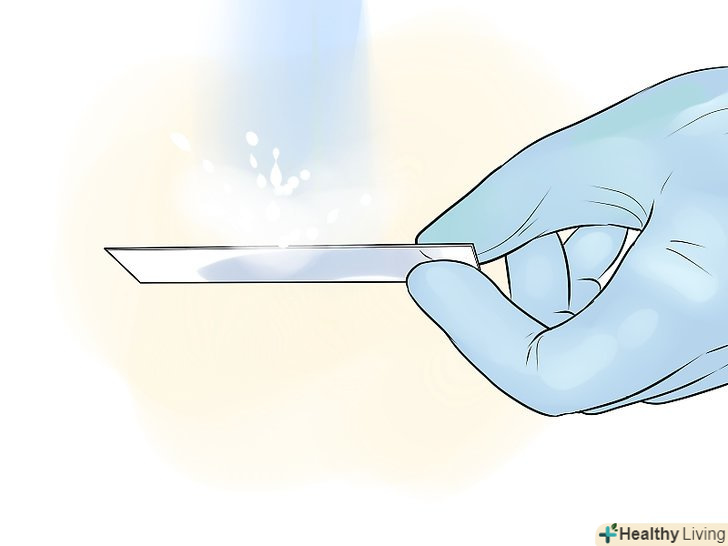
 Зафіксуйте зразок.під дією тепла бактерії пристануть до скла, і їх не змиє при фарбуванні. Швидко проведіть 2-3 рази предметним склом над верхньою частиною полум'я пальника або нагрійте його на електричному нагрівачі. Не перегрійте предметне скло, щоб не внести зміни в зразок. Якщо ви використовуєте пальник Бунзена, стежте, щоб полум'я було невеликим і мало вигляд блакитного конуса, а не високого оранжевого стовпа.[7]
Зафіксуйте зразок.під дією тепла бактерії пристануть до скла, і їх не змиє при фарбуванні. Швидко проведіть 2-3 рази предметним склом над верхньою частиною полум'я пальника або нагрійте його на електричному нагрівачі. Не перегрійте предметне скло, щоб не внести зміни в зразок. Якщо ви використовуєте пальник Бунзена, стежте, щоб полум'я було невеликим і мало вигляд блакитного конуса, а не високого оранжевого стовпа.[7]- Можна зафіксувати препарат і метанолом. Нанесіть на висушений зразок 1-2 краплі метилового спирту, злийте надлишки спирту і висушіть предметне скло на повітрі. Даний спосіб краще в силу того, що він менше пошкоджує досліджувані клітини і дає більш чистий фон.
 Помістіть предметне скло в лоток для фарбування.цей лоток являє собою неглибоке металеве, скляне або пластикове блюдце з дрібною сіткою для підтримки зразків. Покладіть скло з препаратом на сітку, так щоб використовувана при фарбуванні рідина стікала в лоток.
Помістіть предметне скло в лоток для фарбування.цей лоток являє собою неглибоке металеве, скляне або пластикове блюдце з дрібною сіткою для підтримки зразків. Покладіть скло з препаратом на сітку, так щоб використовувана при фарбуванні рідина стікала в лоток.- Якщо у вас немає лотка для фарбування, предметне скло можна покласти поверх пластикової форми для льоду.[8]
Частина2З 3:
Проведення фарбування по Граму
Частина2З 3:
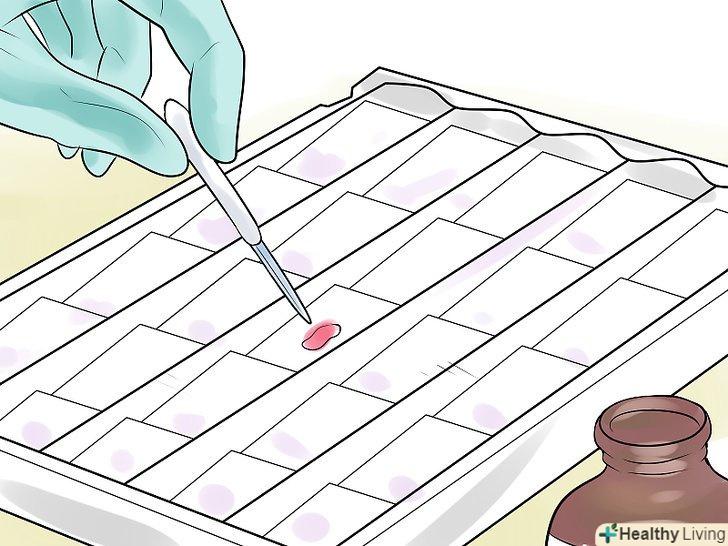
 Нанесіть на зразок розчин кристалічного фіолетового (кристалвіолету).наберіть розчин кристалічного фіолетового (його іноді називають генціановим фіолетовим) в піпетку і нанесіть кілька крапель на препарат. Зачекайте 30-60 секунд. Кристалічний фіолетовий (КФ) дисоціює у воді з утворенням іонів КФ+ і хлору (Cl–). Ці іони проникають через клітинну оболонку і мембрану як грампозитивних, так і грамнегативних клітин. Іони КФ + взаємодіють з негативно зарядженими компонентами бактеріальних клітин і забарвлюють їх у фіолетовий колір.
Нанесіть на зразок розчин кристалічного фіолетового (кристалвіолету).наберіть розчин кристалічного фіолетового (його іноді називають генціановим фіолетовим) в піпетку і нанесіть кілька крапель на препарат. Зачекайте 30-60 секунд. Кристалічний фіолетовий (КФ) дисоціює у воді з утворенням іонів КФ+ і хлору (Cl–). Ці іони проникають через клітинну оболонку і мембрану як грампозитивних, так і грамнегативних клітин. Іони КФ + взаємодіють з негативно зарядженими компонентами бактеріальних клітин і забарвлюють їх у фіолетовий колір.- У багатьох лабораторіях використовують "кристалвіолет Хукера". У цю модифікацію входить щавлевокислий амоній, який запобігає випаданню осаду.[9]
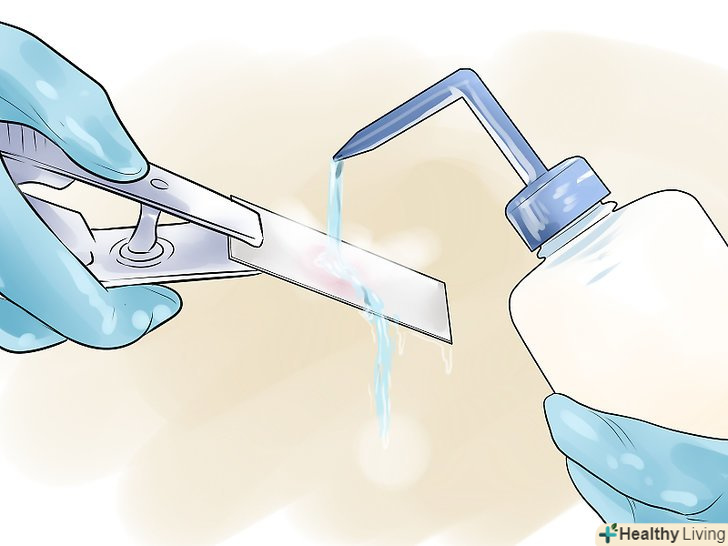
 Акуратно змийте барвник водою.Нахиліть предметне скло і пустіть на нього слабкий струмінь дистильованої або водопровідної води з промивної склянки. Направляйте струмінь в сторону від препарату, щоб вода лише злегка омивала його.[10] Будьте обережні, так як занадто сильний натиск може змити грампозитивні бактерії.
Акуратно змийте барвник водою.Нахиліть предметне скло і пустіть на нього слабкий струмінь дистильованої або водопровідної води з промивної склянки. Направляйте струмінь в сторону від препарату, щоб вода лише злегка омивала його.[10] Будьте обережні, так як занадто сильний натиск може змити грампозитивні бактерії. Нанесіть на зразок йод, потім змийте його.за допомогою піпетки покрийте зразок йодом. Залиште йод хоча б на 60 секунд, після чого акуратно змийте його водою так само, як раніше змили барвник.[11] Йод у вигляді негативно заряджених іонів взаємодіє з іонами КФ+, в результаті чого в зовнішніх і внутрішніх шарах клітин формуються великі комплекси кристалвіолету і йоду. Це фіксує потрапив в клітини кристалвіолет.
Нанесіть на зразок йод, потім змийте його.за допомогою піпетки покрийте зразок йодом. Залиште йод хоча б на 60 секунд, після чого акуратно змийте його водою так само, як раніше змили барвник.[11] Йод у вигляді негативно заряджених іонів взаємодіє з іонами КФ+, в результаті чого в зовнішніх і внутрішніх шарах клітин формуються великі комплекси кристалвіолету і йоду. Це фіксує потрапив в клітини кристалвіолет.- Йод є їдкою речовиною. Уникайте контакту йоду зі шкірою, не ковтайте його і не вдихайте його пари.
 Додайте знебарвлюючу речовину і відразу ж змийте його.зазвичай використовують суміш ацетону і етанолу в пропорції 1:1, при цьому слід акуратно витримати час. Розташуйте предметне скло під кутом і додавайте на нього знебарвлюючий засіб до тих пір, поки стікає рідина не втратить фіолетовий відтінок і стане прозорою. Зазвичай це займає не більше 10 секунд, особливо якщо знебарвлюючий розчин містить велику кількість ацетону. Якщо ви вчасно не зупинитеся, розчин може вимити барвник як з грампозитивних, так і грамнегативних клітин, і вам доведеться повторити процедуру фарбування. Негайно змийте залишки знебарвлюючого розчину так само, як робили це раніше з барвником.
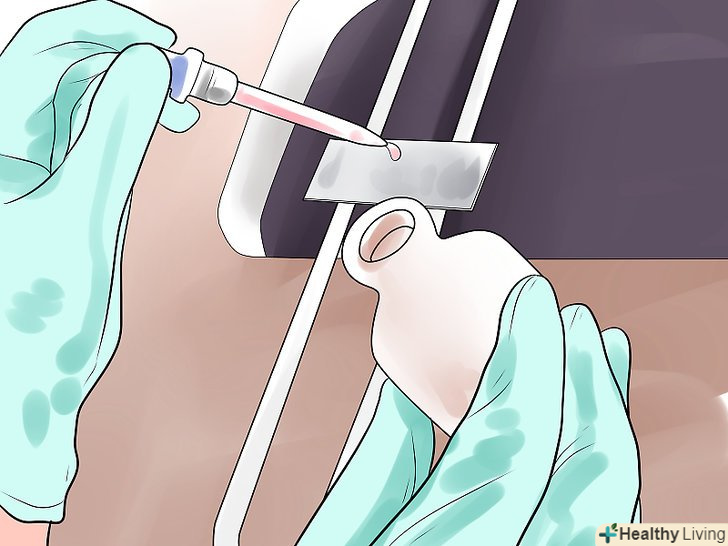
Додайте знебарвлюючу речовину і відразу ж змийте його.зазвичай використовують суміш ацетону і етанолу в пропорції 1:1, при цьому слід акуратно витримати час. Розташуйте предметне скло під кутом і додавайте на нього знебарвлюючий засіб до тих пір, поки стікає рідина не втратить фіолетовий відтінок і стане прозорою. Зазвичай це займає не більше 10 секунд, особливо якщо знебарвлюючий розчин містить велику кількість ацетону. Якщо ви вчасно не зупинитеся, розчин може вимити барвник як з грампозитивних, так і грамнегативних клітин, і вам доведеться повторити процедуру фарбування. Негайно змийте залишки знебарвлюючого розчину так само, як робили це раніше з барвником. Нанесіть на зразок контрастний барвник і змийте його водою.контрастний барвник, в якості якого використовують зазвичай сафранін або фуксин, дозволяє отримати додатковий контраст між грампозитивними і грамнегативними клітинами за рахунок того, що забарвлює безбарвні (грамнегативні) бактерії в рожевий або червоний колір.[14][15] залиште контрастний барвник на зразку хоча б на 45 секунд, після чого змийте його водою.[16]
Нанесіть на зразок контрастний барвник і змийте його водою.контрастний барвник, в якості якого використовують зазвичай сафранін або фуксин, дозволяє отримати додатковий контраст між грампозитивними і грамнегативними клітинами за рахунок того, що забарвлює безбарвні (грамнегативні) бактерії в рожевий або червоний колір.[14][15] залиште контрастний барвник на зразку хоча б на 45 секунд, після чого змийте його водою.[16]- Фуксин надає багатьом грамнегативним бактеріям (наприклад, таким якhaemophilus і legionella) більш інтенсивний колір.[17] зважаючи на це його рекомендується використовувати новачкам.
 Висушіть предметне скло.можна просто залишити його на повітрі, або промокнути фільтрувальним папером.[18] після цього фарбування по Граму завершено.
Висушіть предметне скло.можна просто залишити його на повітрі, або промокнути фільтрувальним папером.[18] після цього фарбування по Граму завершено.
Частина3З 3:
Перевірка результатів
Частина3З 3:
 Підготуйте оптичний мікроскоп.покладіть скло зі зразком на предметний столик. Бактерії значно відрізняються за розмірами, тому вам може знадобитися збільшення від 400x до 1000x.[19] при тисячократному збільшенні для кращого контрасту рекомендується використовувати об'єктив з масляною імерсією. Нанесіть на предметне скло краплю імерсійного масла, і при цьому намагайтеся, щоб скло не рухалося, інакше в маслі можуть утворитися бульбашки.[20] потім за допомогою турелі мікроскопа виставте необхідний Вам об'єктив так, щоб він торкнувся масла.
Підготуйте оптичний мікроскоп.покладіть скло зі зразком на предметний столик. Бактерії значно відрізняються за розмірами, тому вам може знадобитися збільшення від 400x до 1000x.[19] при тисячократному збільшенні для кращого контрасту рекомендується використовувати об'єктив з масляною імерсією. Нанесіть на предметне скло краплю імерсійного масла, і при цьому намагайтеся, щоб скло не рухалося, інакше в маслі можуть утворитися бульбашки.[20] потім за допомогою турелі мікроскопа виставте необхідний Вам об'єктив так, щоб він торкнувся масла.- Метод Масляної імерсії застосуємо лише для спеціальних, а не "сухих" об'єктивів.
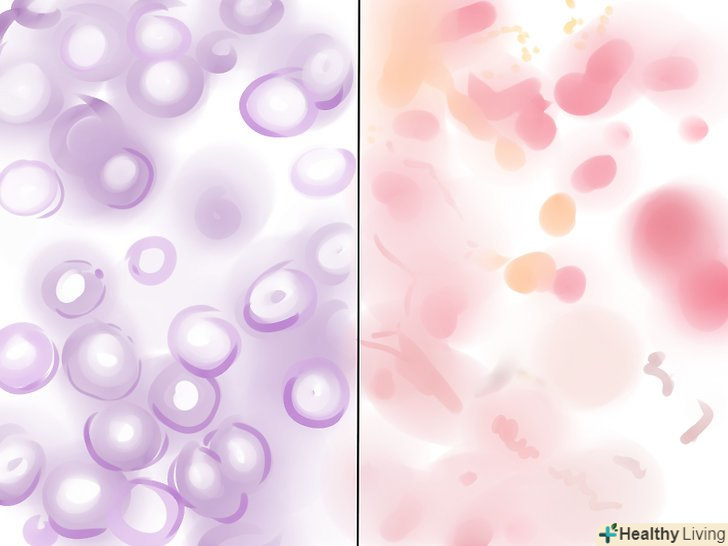
 Визначте грампозитивні та грамнегативні бактерії. Розгляньте предметне скло під оптичним мікроскопом. Грампозитивні бактерії будуть пофарбовані у фіолетовий колір, оскільки всередині їх товстих клітинних стінок виявився кристалвіолет. Грамнегативні бактерії повинні бути рожевими або червоними, так як кристалвіолет був вимитий через їх тонкі клітинні стінки, після чого в них проник рожевий контрастний барвник.
Визначте грампозитивні та грамнегативні бактерії. Розгляньте предметне скло під оптичним мікроскопом. Грампозитивні бактерії будуть пофарбовані у фіолетовий колір, оскільки всередині їх товстих клітинних стінок виявився кристалвіолет. Грамнегативні бактерії повинні бути рожевими або червоними, так як кристалвіолет був вимитий через їх тонкі клітинні стінки, після чого в них проник рожевий контрастний барвник.- Якщо зразок занадто товстий, це може призвести до помилкових позитивних результатів. Якщо бактерії всіх типів виглядають як грампозитивні, пофарбуйте ще один зразок, щоб упевнитися в правильності результатів.
- Якщо зразок занадто довго перебував під впливом знебарвлюючого розчину, це може привести до помилкових негативних результатів. Пофарбуйте ще один зразок, щоб переконатися в тому, що всі бактерії дійсно грамнегативні.
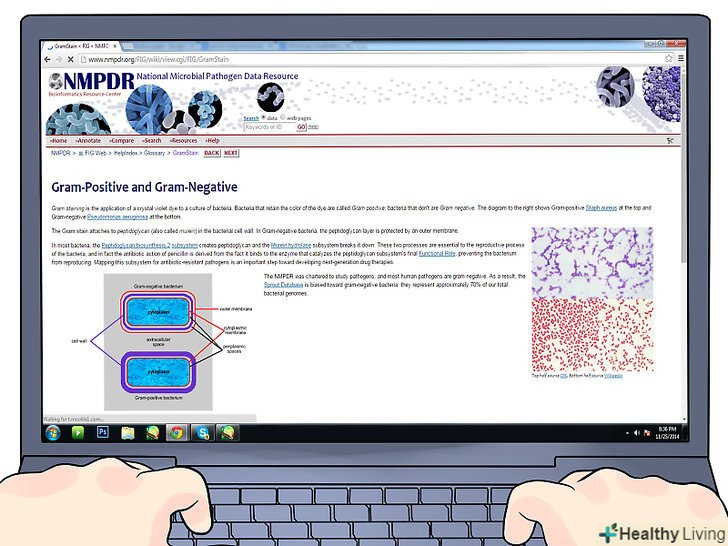
 Порівняйте свої результати з еталонними зображеннями.якщо ви не впевнені в тому, які бактерії бачите, то перегляньте набір еталонних зображень, які відсортовані за формою бактерій і результатами фарбування за Грамом. Подібний набір можна знайти в Інтернеті на National Microbial Pathogen Database, Bacteria in Photos і багатьох інших сайтах. Нижче наведені найбільш поширені або важливі для діагностики приклади, які допоможуть вам ідентифікувати бактерії.
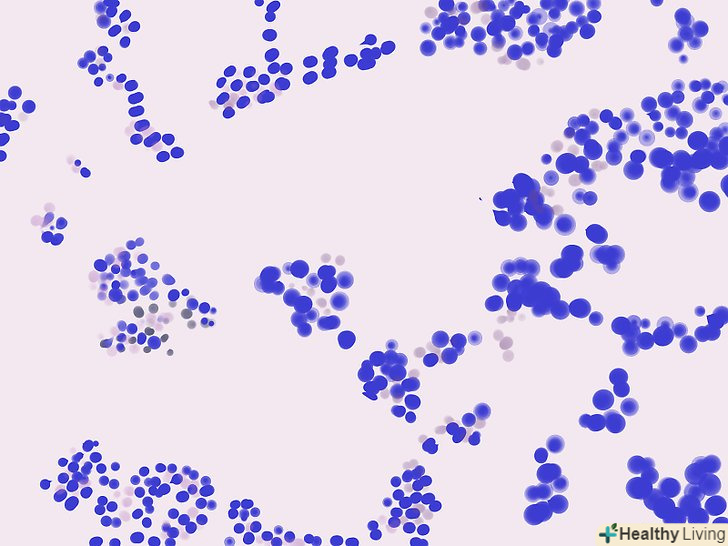
Порівняйте свої результати з еталонними зображеннями.якщо ви не впевнені в тому, які бактерії бачите, то перегляньте набір еталонних зображень, які відсортовані за формою бактерій і результатами фарбування за Грамом. Подібний набір можна знайти в Інтернеті на National Microbial Pathogen Database, Bacteria in Photos і багатьох інших сайтах. Нижче наведені найбільш поширені або важливі для діагностики приклади, які допоможуть вам ідентифікувати бактерії. Розпізнайте грампозитивні бактерії за формою.Вид бактерій можна визначити за їх формою в мікроскопі: часто це бувають коки (округлі) і бацили (паличкоподібні). Ось кілька поширених форм грампозитивних (фіолетових) бактерій:
Розпізнайте грампозитивні бактерії за формою.Вид бактерій можна визначити за їх формою в мікроскопі: часто це бувають коки (округлі) і бацили (паличкоподібні). Ось кілька поширених форм грампозитивних (фіолетових) бактерій:- Грампозитивні коки — як правило це стафілококи (у вигляді виноградних грон) або стрептококи (утворюють ланцюжки).
- Грампозитивні палички включають в себе бацили, клостридії, коринебактерииі лістерії. Представники родуактиноміцети часто мають відгалуження і нитки.[21]
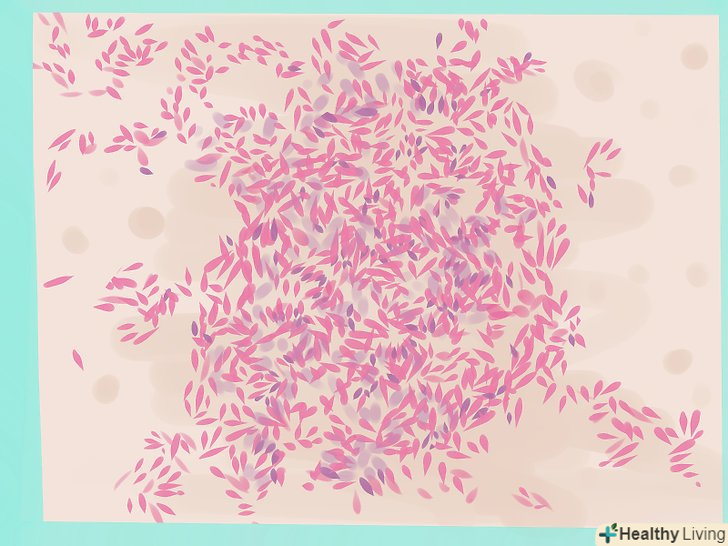
 Розпізнайте грамнегативні бактерії.часто грамнегативні (рожеві) бактерії поділяють на три групи: коки (округлі), паличкоподібні (довгі і тонкі) і кокковідние, які мають проміжну форму.
Розпізнайте грамнегативні бактерії.часто грамнегативні (рожеві) бактерії поділяють на три групи: коки (округлі), паличкоподібні (довгі і тонкі) і кокковідние, які мають проміжну форму.- Грамнегативні коки найчастіше представлені різними видамиNeisseria .
- Грамнегативні палички включають в себекишкову паличку ,ентеробактерії ,клебсієли ,цитробактерії ,серратії ,протеї ,сальмонели ,шигели ,псевдомонади і багато інших. холерні вібріони також можуть мати вигляд звичайних або вигнутих паличок.[22]
- Грамнегативні" кокковидні "палички (або"коккобацили") включають в себе бордетелли, бруцели, гемофіли і пастерели.
 Оцініть неоднозначні результати.деякі бактерії не піддаються однозначному фарбуванню через те, що їх клітинні стінки неміцні або покриті жирами. Такі бактерії можуть одночасно фарбуватися в фіолетовий і рожевий колір в межах однієї клітини, або клітини одного і того ж виду можуть фарбуватися по-різному в одному мазку. Подібна проблема може спостерігатися на будь-якому зразку бактерій, який пролежав більше 24 годин, проте деякі види бактерій схильні до цього незалежно від свіжості зразка. У цьому випадку для точного визначення бактерій можуть знадобитися більш спеціалізовані методи, такі як забарвлення по цілю-Нільсену, спостереження за ростом культури, тест TSI (потрійний цукор заліза), генетичне тестування.[23]
Оцініть неоднозначні результати.деякі бактерії не піддаються однозначному фарбуванню через те, що їх клітинні стінки неміцні або покриті жирами. Такі бактерії можуть одночасно фарбуватися в фіолетовий і рожевий колір в межах однієї клітини, або клітини одного і того ж виду можуть фарбуватися по-різному в одному мазку. Подібна проблема може спостерігатися на будь-якому зразку бактерій, який пролежав більше 24 годин, проте деякі види бактерій схильні до цього незалежно від свіжості зразка. У цьому випадку для точного визначення бактерій можуть знадобитися більш спеціалізовані методи, такі як забарвлення по цілю-Нільсену, спостереження за ростом культури, тест TSI (потрійний цукор заліза), генетичне тестування.[23] Викиньте використані матеріали.процедура утилізації відходів залежить від конкретної лабораторії і того, які матеріали використовувалися. Як правило, рідина з лотка для фарбування вважається небезпечним матеріалом і переливається в щільно закриваються пляшки. Використані Предметні скла вимочуються в 10%-ному розчині відбілювача, після чого поміщаються в контейнери для збору та утилізації голок і медичних відходів.
Викиньте використані матеріали.процедура утилізації відходів залежить від конкретної лабораторії і того, які матеріали використовувалися. Як правило, рідина з лотка для фарбування вважається небезпечним матеріалом і переливається в щільно закриваються пляшки. Використані Предметні скла вимочуються в 10%-ному розчині відбілювача, після чого поміщаються в контейнери для збору та утилізації голок і медичних відходів.
Поради
- Пам'ятайте про те, що результати фарбування по Граму багато в чому визначаються тим, наскільки хороший зразок. Необхідно навчити пацієнтів отримувати хороші зразки для аналізу (наприклад, мокроту після глибокого кашлю, а не просту слину).
- При знебарвленні етиловий спирт діє повільніше, ніж ацетон.
- При роботі в лабораторії дотримуйтесь стандартну техніку безпеки.
- Для практики використовуйте ватяну паличку, оскільки зразок повинен містити як грампозитивні, так і грамнегативні бактерії. Якщо спостерігається лише один тип бактерій, то це, швидше за все, означає, що ви або недостатньо, або занадто сильно обробили зразок знебарвлюючим розчином.[26]
- Предметні скла можна брати дерев'яною прищіпкою.[27]
Попередження
- Ацетон і спирт вогненебезпечні. При попаданні на долоні ацетон знежирює шкіру, в результаті чого в неї легше вбираються інші речовини. Одягайте рукавички і дотримуйтесь інших запобіжних заходів.
- Слідкуйте за тим, щоб препарат не висох, перш ніж ви змиєте основний або контрастний барвник.[28]
Що вам знадобиться
- зразок тканини
- скляні Предметні скла
- піпетка
- джерело полум'я, нагрівач предметних стекол або метанол
- Вода
- кристалічний фіолетовий
- Йод
- знебарвлююча рідина, наприклад спирт або ацетон
Джерела
- Isenberg, H.D. (ed). 1992. Clinical Microbiology Procedures Handbook . American Society for Microbiology, Washington, D.C.
- Isenberg, H.D. (ed). 1995. Essential Procedures for clinical Microbiology. American Society for Microbiology, Washington, D.C.
- ↑ Bergey, David H.; John G. Holt; Noel R. Krieg; Peter H.A. Sneath (1994). Bergey's Manual of Determinative Bacteriology (9th ed.). Lippincott Williams &#amp; Wilkins.
- ↑ Gram, HC (1884). "Über die isolierte Färbung der Schizomyceten in Schnitt- und Trockenpräparaten" (in German). Fortschritte der Medizin 2: 185–9.
- ↑ Http://www.microbelibrary.org/library/gram-stain/2886-gram-stain-protocols
- ↑ Http://amrita.vlab.co.in/?sub=3&#amp;brch=73&#amp;sim=208&#amp;cnt=2
- ↑ Http://www.austincc.edu/microbugz/gram_stain.php
- ↑ Http://amrita.vlab.co.in/?sub=3&#amp;brch=73&#amp;sim=208&#amp;cnt=2
- ↑ Http://amrita.vlab.co.in/?sub=3&#amp;brch=73&#amp;sim=208&#amp;cnt=2
- ↑ Http://www.buffalo.edu/content/dam/www/facilities/ehs/policies/lab-safety-policies/Gram%20Staining%20Waste%20Procedure.pdf
- ↑ Http://www.microbelibrary.org/library/gram-stain/2886-gram-stain-protocols
- ↑ Http://iws.collin.edu/mweis/Microbiology/Lab/Lab%20Discussions_Handouts/Gram%20Stain%20Steps.pdf
- ↑ Http://amrita.vlab.co.in/?sub=3&#amp;brch=73&#amp;sim=208&#amp;cnt=2
- ↑ Http://www.microbelibrary.org/library/gram-stain/2886-gram-stain-protocols
- ↑ Http://www.microbelibrary.org/library/gram-stain/2886-gram-stain-protocols
- ↑ Beveridge TJ, Davies JA (November 1983). "Cellular responses of Bacillus subtilis and Escherichia coli to the Gram stain". Journal of bacteriology 156 (2): 846–58.
- ↑ Davies JA, Anderson GK, Beveridge TJ, Clark HC (November 1983). "Chemical mechanism of the Gram stain and synthesis of a new electron-opaque marker for electron microscopy which replaces the iodine mordant of the stain". Journal of bacteriology 156 (2): 837–45.
- ↑ Http://amrita.vlab.co.in/?sub=3&#amp;brch=73&#amp;sim=208&#amp;cnt=2
- ↑ Http://www.uphs.upenn.edu/bugdrug/antibiotic_manual/gram1.htm
- ↑ Http://amrita.vlab.co.in/?sub=3&#amp;brch=73&#amp;sim=208&#amp;cnt=2
- ↑ Http://www.microscope.com/education-center/how-to-guides/grams-stain/
- ↑ Http://www.cargille.com/immersionoilmicroscope.shtml
- ↑ Http://www.ncbi.nlm.nih.gov/books/NBK8385/
- ↑ Http://amrita.vlab.co.in/?sub=3&#amp;brch=73&#amp;sim=208&#amp;cnt=2
- ↑ Http://archive.crohn.ie/primer/bactid.htm
- ↑ Http://www.microrao.com/micronotes/pg/Gram%20stain.pdf
- ↑ Http://www.microrao.com/micronotes/pg/Gram%20stain.pdf
- ↑ Http://www.microscope.com/education-center/how-to-guides/grams-stain/
- ↑Http://www.flinnsci.com/teacher-resources/biology/frequently-asked-biology-questions/culture-media-and-stains-preparation-and-use-tips/how-do-i-perform-a-gram-stain/
- ↑ Http://www.flinnsci.com/teacher-resources/biology/frequently-asked-biology-questions/culture-media-and-stains-preparation-and-use-tips/how-do-i-perform-a-gram-stain/