В хімії електронегативність-це здатність атомів притягувати до себе електрони інших атомів.[1] Атом з високою електронегативністю притягує електрони сильно, а атом з низькою електронегативністю притягує електрони слабо. Значення електронегативності використовуються при прогнозуванні поведінки різних атомів в хімічних сполуках.
Кроки
Метод1З 3:
Основи
Метод1З 3:
 Хімічні зв'язки.такі зв'язки виникають, коли електрони в атомах взаємодіють один з одним, тобто два електрони (по одному з кожного атома) стають загальними.
Хімічні зв'язки.такі зв'язки виникають, коли електрони в атомах взаємодіють один з одним, тобто два електрони (по одному з кожного атома) стають загальними.- Опис причин взаємодії електронів в атомах виходить за рамки даної статті. Для отримання детальної інформації з цього питання прочитайте, наприклад,эту статтю.
 Вплив електронегативності.коли два атоми притягують електрони один одного, то сила тяжіння не є однаковою. Атом з більш високою електронегативністю притягує два електрона сильніше. Атом з дуже високою електронегативністю притягує електрони з такою силою, що про загальні електронах мова вже не йде.
Вплив електронегативності.коли два атоми притягують електрони один одного, то сила тяжіння не є однаковою. Атом з більш високою електронегативністю притягує два електрона сильніше. Атом з дуже високою електронегативністю притягує електрони з такою силою, що про загальні електронах мова вже не йде.- Наприклад, в молекулі NaCl (хлорид натрію, звичайна сіль) атом хлору має досить високу електронегативність, а атом натрію — досить низьку. Таким чином, електрони притягуються до атома хлору і відштовхуються від атомів натрію.
 Таблиця електронегативності.ця таблиця включає хімічні елементи, розташовані так само, як в таблиці Менделєєва, але для кожного елемента приведена електронегативність його атомів. Таку таблицю можна знайти в підручниках з хімії, довідкових матеріалах і в мережі.
Таблиця електронегативності.ця таблиця включає хімічні елементи, розташовані так само, як в таблиці Менделєєва, але для кожного елемента приведена електронегативність його атомів. Таку таблицю можна знайти в підручниках з хімії, довідкових матеріалах і в мережі. Тенденції електронегативності.якщо у вас під рукою немає таблиці електронегативності, ви можете оцінити електронегативність атома по розташуванню елемента в таблиці Менделєєва.
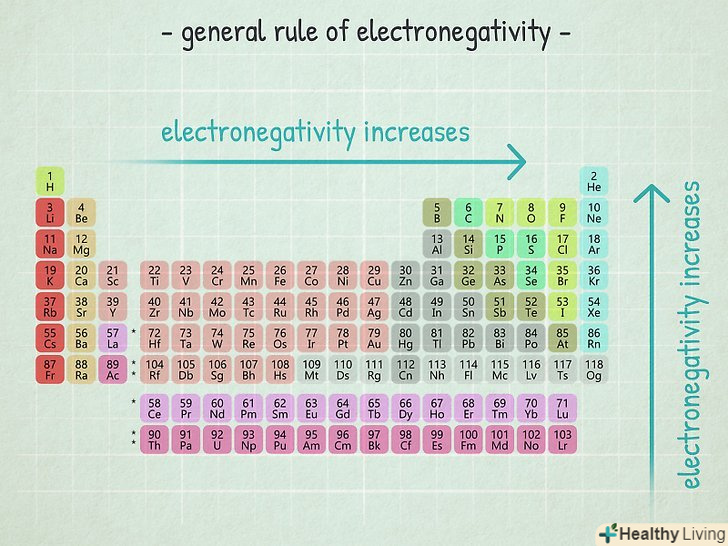
Тенденції електронегативності.якщо у вас під рукою немає таблиці електронегативності, ви можете оцінити електронегативність атома по розташуванню елемента в таблиці Менделєєва.- Чим правіше розташований елемент, тим більше електронегативність його атома.
- Чим вище розташований елемент, тим більше електронегативність його атома.
- Таким чином, атоми елементів, розташованих в правому верхньому куті таблиці Менделєєва, мають найвищі електронегативності, а атоми елементів, розташованих в нижньому лівому кутку-найнижчі.
- У нашому прикладі NaCl можна сказати, що хлор має більш високу електронегативність, ніж натрій, тому що хлор розташований правіше натрію.
Метод2 З 3:
Визначення типу зв'язку по електронегативності
Метод2 З 3:
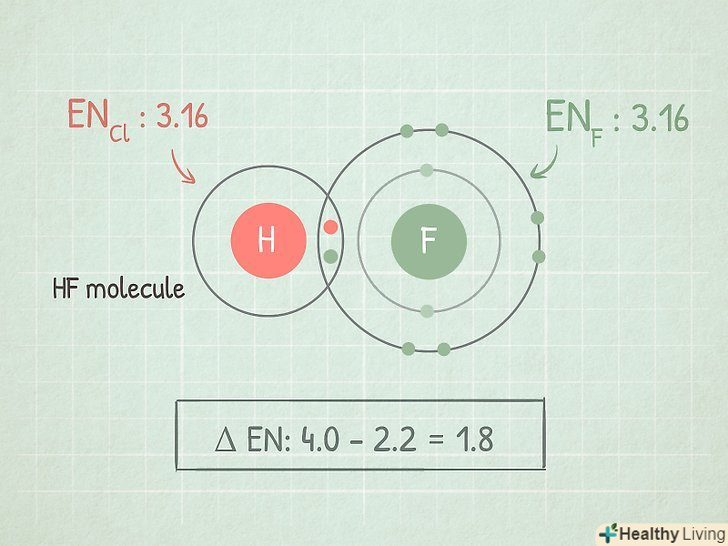
 Обчисліть різницю між електронегативностями двох атомів, щоб зрозуміти характеристики зв'язку між ними.для цього відніміть меншу електронегативність з більшої.
Обчисліть різницю між електронегативностями двох атомів, щоб зрозуміти характеристики зв'язку між ними.для цього відніміть меншу електронегативність з більшої.- Наприклад, розглянемо молекулу HF. Відніміть електронегативність водню (2,1) з електронегативності фтору (4,0): 4,0 – 2,1 =1,9.
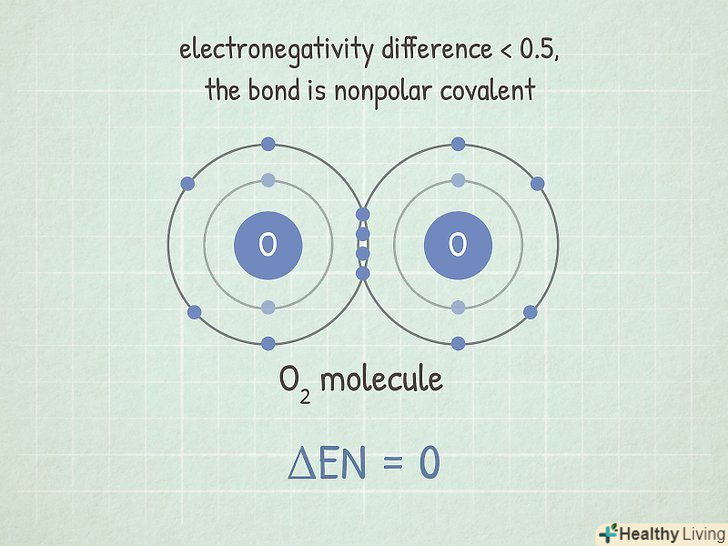
 Якщо різниця менше 0,5, то зв'язок ковалентний неполярний, при якій електрони притягуються практично з однаковою силою.такі зв'язки утворюються між двома однаковими атомами. Неполярні зв'язки, як правило, дуже важко зруйнувати.[3] все тому, що атоми діляться електронами, що робити їх зв'язок стабільною. Щоб зруйнувати її, потрібно багато енергії.[4]
Якщо різниця менше 0,5, то зв'язок ковалентний неполярний, при якій електрони притягуються практично з однаковою силою.такі зв'язки утворюються між двома однаковими атомами. Неполярні зв'язки, як правило, дуже важко зруйнувати.[3] все тому, що атоми діляться електронами, що робити їх зв'язок стабільною. Щоб зруйнувати її, потрібно багато енергії.[4]- Наприклад, молекула O2 має цей тип зв'язку. Оскільки два атоми кисню мають однакову електронегативність, різниця між ними дорівнює 0.
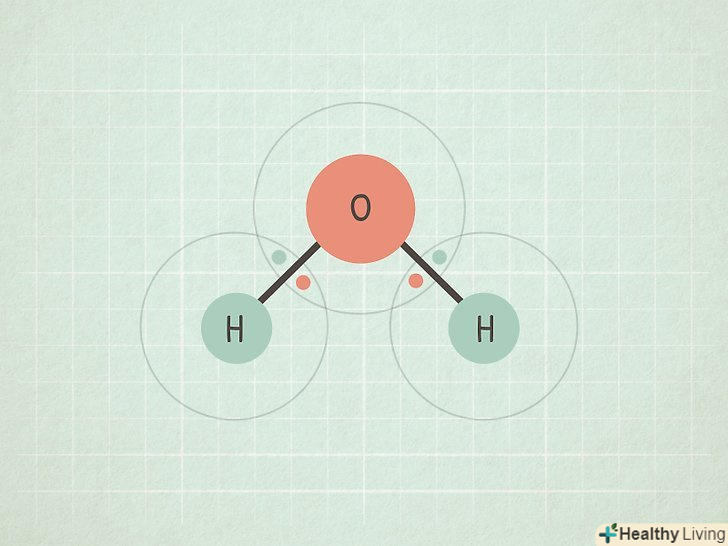
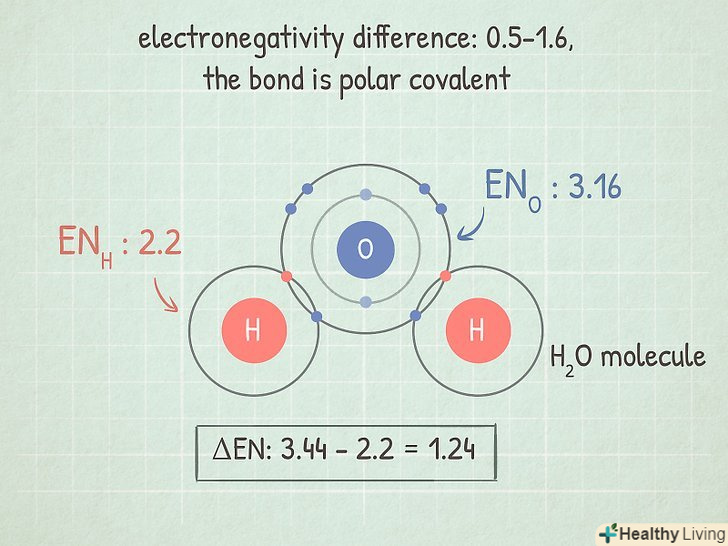
 Якщо різниця лежить в межах 0,5-1,6, то зв'язок ковалентний Полярний.у цьому випадку один з двох атомів притягує електрони сильніше і тому набуває частковий негативний заряд, а другий — частковий позитивний заряд. Такий дисбаланс в зарядах дозволяє молекулі брати участь в деяких реакціях.[5]
Якщо різниця лежить в межах 0,5-1,6, то зв'язок ковалентний Полярний.у цьому випадку один з двох атомів притягує електрони сильніше і тому набуває частковий негативний заряд, а другий — частковий позитивний заряд. Такий дисбаланс в зарядах дозволяє молекулі брати участь в деяких реакціях.[5]- Наприклад, молекула H2O (вода) має такий тип зв'язку. Атом О більш електронегативний, ніж два атома H, тому кисень притягує електрони сильніше і набуває частковий негативний заряд, а водень — частковий позитивний заряд.
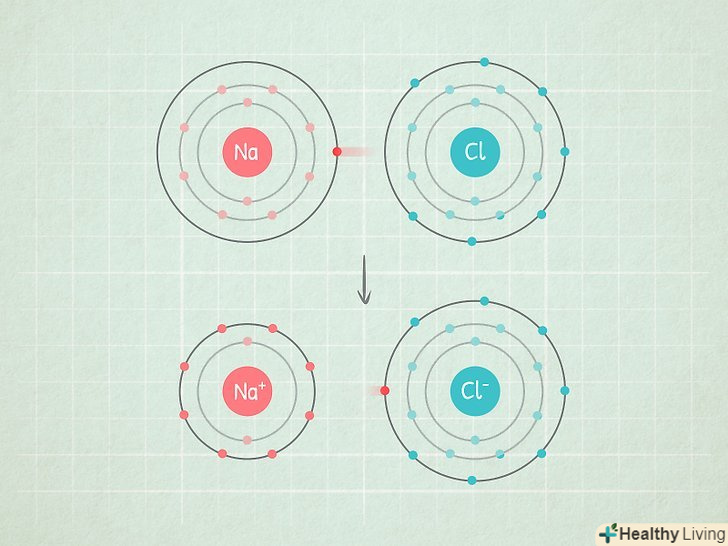
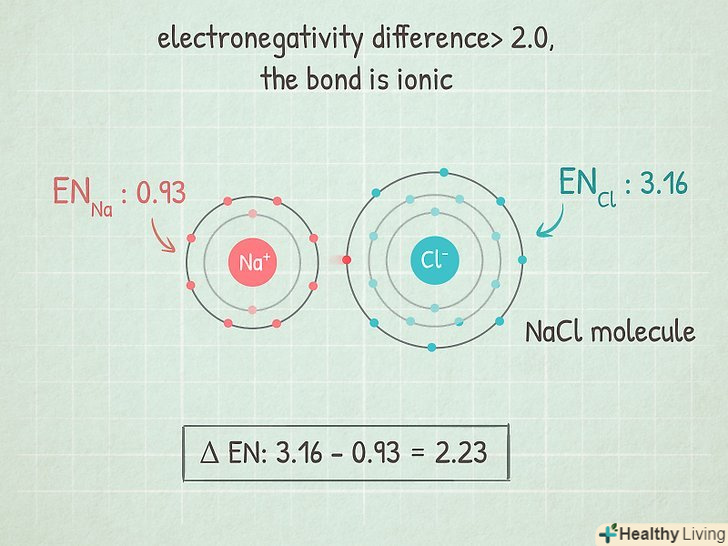
 Якщо різниця більше 2,0, то зв'язок іонна. це зв'язок, при якій загальна електронна пара переходить переважно до атома з більшою електронегативністю, який набуває негативний заряд, а атом з меншою електронегативністю набуває позитивний заряд. Молекули з такими зв'язками добре реагують з іншими атомами і навіть можуть бути зруйновані полярними атомами.
Якщо різниця більше 2,0, то зв'язок іонна. це зв'язок, при якій загальна електронна пара переходить переважно до атома з більшою електронегативністю, який набуває негативний заряд, а атом з меншою електронегативністю набуває позитивний заряд. Молекули з такими зв'язками добре реагують з іншими атомами і навіть можуть бути зруйновані полярними атомами.- Наприклад, молекула NaCl (хлорид натрію) має такий тип зв'язку. Атом хлору настільки електронегативний, що притягує до себе обидва електрона і набуває негативний заряд, а атом натрію набуває позитивний заряд.
- NaCl може бути зруйнований полярною молекулою, такою як H2O (вода). У молекулі води воднева сторона молекули позитивна, а киснева сторона негативна. Якщо змішати сіль з водою, молекули води розщеплять молекули солі, в наслідок чого вона розчиниться.[6]
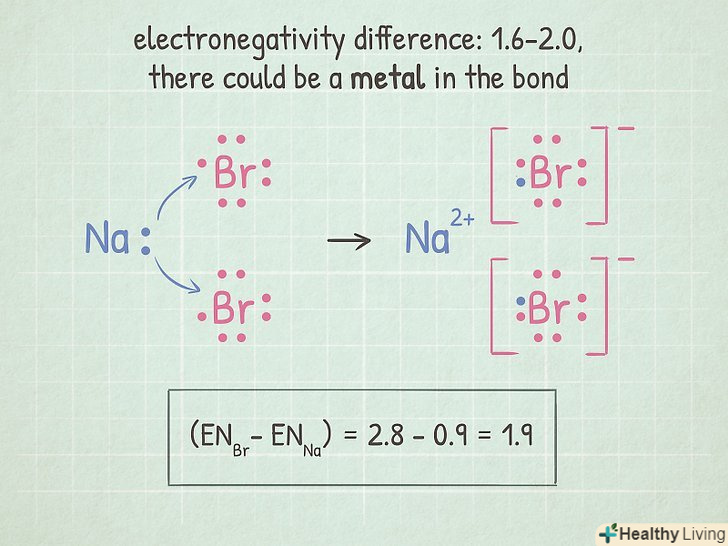
 Якщо різниця лежить в межах 1,6-2,0, перевірте наявність металу.якщо в молекулі присутній атом металу, то зв'язок іонна. Якщо в молекулі атомів металу немає, то зв'язок Полярна ковалентний.
Якщо різниця лежить в межах 1,6-2,0, перевірте наявність металу.якщо в молекулі присутній атом металу, то зв'язок іонна. Якщо в молекулі атомів металу немає, то зв'язок Полярна ковалентний.
Метод3 З 3:
Обчислення електронегативності за Маллікеном
Метод3 З 3:
 Знайдіть першу енергію іонізації атома.Шкала електронегативності по Маллікену трохи відрізняється від шкали по Полінгу, яка згадувалася вище. Перша енергія іонізації потрібна для видалення одного атома з електрона.
Знайдіть першу енергію іонізації атома.Шкала електронегативності по Маллікену трохи відрізняється від шкали по Полінгу, яка згадувалася вище. Перша енергія іонізації потрібна для видалення одного атома з електрона.
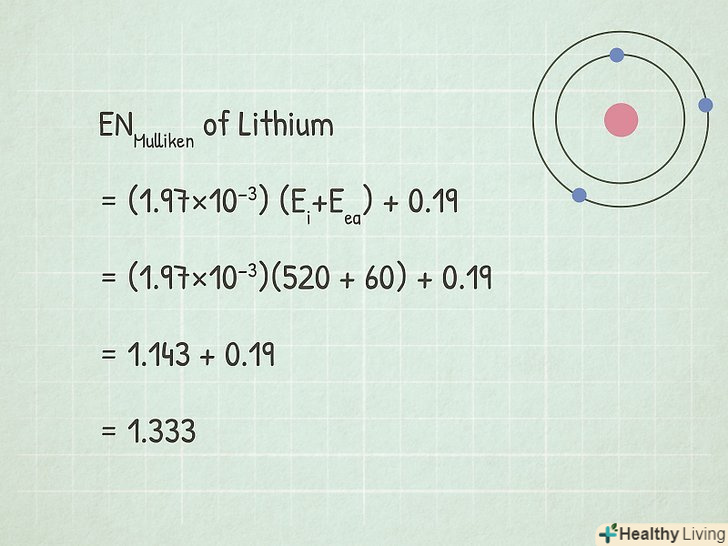
 Скористайтеся рівнянням електронегативності Маллікена:ENMulliken = (1,97 x 10-3)(Ei+Eea) + 0,19 .
Скористайтеся рівнянням електронегативності Маллікена:ENMulliken = (1,97 x 10-3)(Ei+Eea) + 0,19 .- У нашому прикладі:
- ENMulliken = (1,97×10−3)(Ei+Eea) + 0,19
- ENMulliken = (1,97×10−3)(520 + 60) + 0,19
- ENMulliken = 1,143 + 0,19 = 1,333
- У нашому прикладі:
Поради
- Крім шкал по Полінгу і Маллікену, існують шкали електронегативності по Оллреду-Рочоу, Сандерсону, Аллену. Всі вони мають свої власні формули для розрахунку електронегативності (деякі з них досить складні).
- Електронегативність не має одиниць виміру.
Джерела
- ↑ Http://www.chemguide.co.uk/atoms/bonding/electroneg.html
- ↑ Http://www.tutor-homework.com/Chemistry_Help/electronegativity_table/electronegativity.html
- ↑ Http://study.com/academy/lesson/polar-and-nonpolar-covalent-bonds-definitions-and-examples.html
- ↑ Http://www.rsc.org/Education/Teachers/Resources/cfb/water.htm
- ↑ Http://study.com/academy/lesson/polar-and-nonpolar-covalent-bonds-definitions-and-examples.html
- ↑ Https://water.usgs.gov/edu/solvent.html
- ↑ Http://www.tutor-homework.com/Chemistry_Help/electronegativity_table/electronegativity.html
- ↑ Http://chemwiki.ucdavis.edu/Physical_Chemistry/Physical_Properties_of_Matter/Atomic_and_Molecular_Properties/Ionization_Energy
- ↑ Http://chemwiki.ucdavis.edu/Physical_Chemistry/Physical_Properties_of_Matter/Atomic_and_Molecular_Properties/Electron_Affinity