Сульфат міді зустрічається зазвичай у вигляді синього розчину або у формі синіх кристалів. Сульфат міді часто використовують на уроках хімії, оскільки його відносно легко отримати. Його можна використовувати для демонстрації багатьох цікавих реакцій, і з нього можна виростити красиві сині кристали. Крім того, сульфат міді (мідний купорос) широко використовується в сільському господарстві, при догляді за басейнами і в художніх цілях, і його легко можна придбати через Інтернет.[1] це з'єднання можна отримати різними способами в хімічному класі або домашніх умовах. Однак пам'ятайте про те, що сульфат міді подразнює шкіру і токсичний при попаданні всередину організму. При роботі з хімічними реактивами дотримуйтесь техніки безпеки і надягайте захисний одяг, а після експериментів належним чином позбавляйтеся від продуктів реакції.
Кроки
Метод1З 3:
Отримання сульфату міді за допомогою перекису водню
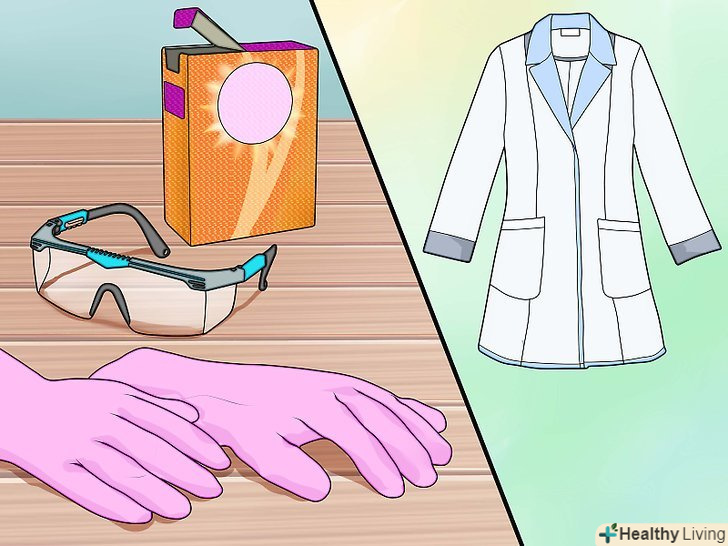
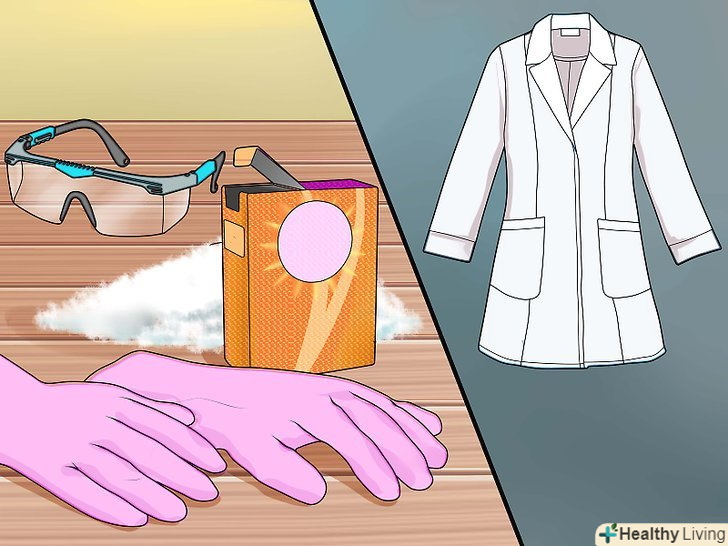
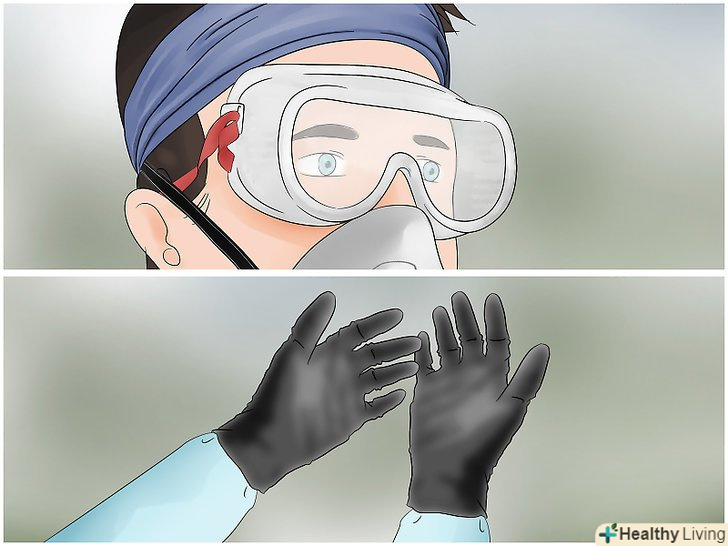
 Вживайте заходів безпеки.вам будуть потрібні захисні окуляри, лабораторний халат або щільна сорочка з довгими рукавами, щоб захиститися від можливих бризок, і кислотостійкі рукавички з латексу або нітрилу. Слід також запастися пачкою харчової соди (бікарбонату натрію), щоб при необхідності нейтралізувати кислоту.
Вживайте заходів безпеки.вам будуть потрібні захисні окуляри, лабораторний халат або щільна сорочка з довгими рукавами, щоб захиститися від можливих бризок, і кислотостійкі рукавички з латексу або нітрилу. Слід також запастися пачкою харчової соди (бікарбонату натрію), щоб при необхідності нейтралізувати кислоту.- Сірчана кислота дуже агресивна. Будьте обережні і не пролийте або не розбризкуйте її.
- Якщо на вашу шкіру потрапить сірчана кислота, відразу ж промийте її холодною водою з милом протягом хоча б 15 хвилин, після чого зверніться за медичною допомогою.
- Якщо сірчана кислота потрапить в очі, промийте їх холодною водою протягом хоча б 30 хвилин, після чого зверніться за медичною допомогою. Щоб цього не сталося, надіньте захисні окуляри!
- Якщо кислота проллється на будь-яку поверхню, посипте її харчовою содою. Зачекайте до тих пір, поки перестануть виділятися бульбашки газу, після чого акуратно витріть поверхню губкою або паперовими рушниками і вимийте забруднені матеріали в раковині великою кількістю води.[2]
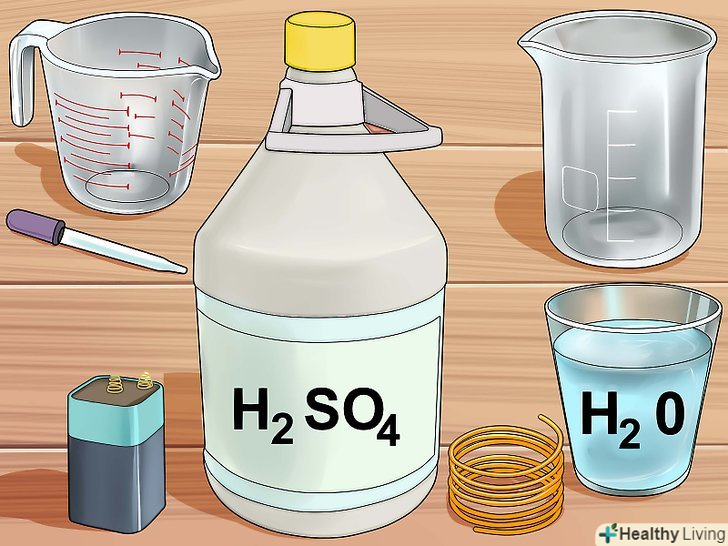
 Зберіть необхідні інструменти.для експерименту вам знадобляться скляний хімічний стакан або гуртка і мензурка з міліметровою шкалою або скляна піпетка. Може знадобитися також скляна паличка або лопатка для того, щоб дістати з розчину зайві шматочки міді, і ваги для зважування металу.
Зберіть необхідні інструменти.для експерименту вам знадобляться скляний хімічний стакан або гуртка і мензурка з міліметровою шкалою або скляна піпетка. Може знадобитися також скляна паличка або лопатка для того, щоб дістати з розчину зайві шматочки міді, і ваги для зважування металу.- Не використовуйте металеву або пластикову посуд, оскільки вона вступить в реакцію з кислотою.
 Виберіть відповідне робоче місце.при даному експерименті буде виділятися надзвичайно вибухонебезпечний газоподібний водень (H2), тому його слід проводити на відкритому повітрі або під витяжкою, далеко від джерел відкритого вогню або легкозаймистих предметів. Необхідно також розмістити все обладнання на кислототривкої, бажано скляної або іншої хімічно стійкої поверхні.[3]
Виберіть відповідне робоче місце.при даному експерименті буде виділятися надзвичайно вибухонебезпечний газоподібний водень (H2), тому його слід проводити на відкритому повітрі або під витяжкою, далеко від джерел відкритого вогню або легкозаймистих предметів. Необхідно також розмістити все обладнання на кислототривкої, бажано скляної або іншої хімічно стійкої поверхні.[3]- Якщо у вас немає хімічно стійкої поверхні, слід принаймні застелити робоче місце листом товстого картону. При попаданні на картон сірчана кислотаобов'язково почне розчиняти його, однак це займе деякий час, протягом якого ви встигнете нейтралізувати її харчовою содою, перш ніж вона роз'їсть картон наскрізь.
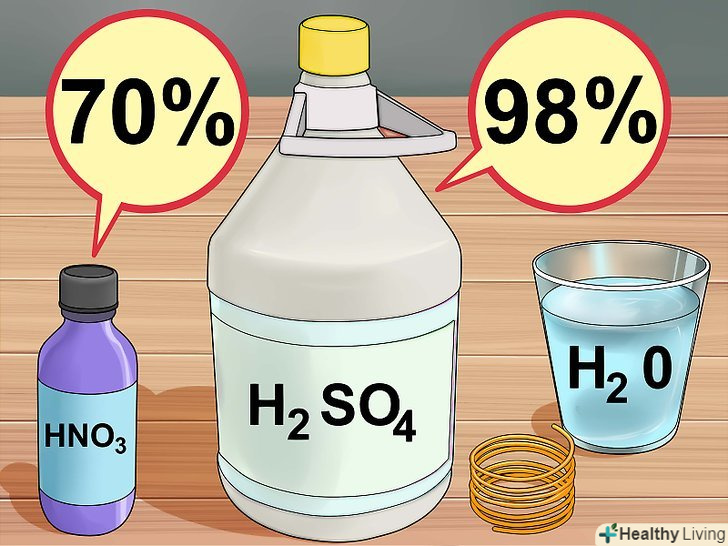
 Зберіть необхідні матеріали.вам знадобляться 30% перекис (пероксид) водню і концентрована 98% сірчана кислота. Обидва реагенту можна замовити в звичайному або інтернет-магазині хімічних реактивів. Крім того, буде потрібно мідний дріт довжиною 7-10 сантиметрів або трохи Мідного брухту, які можна придбати в магазині господарських товарів.[4]
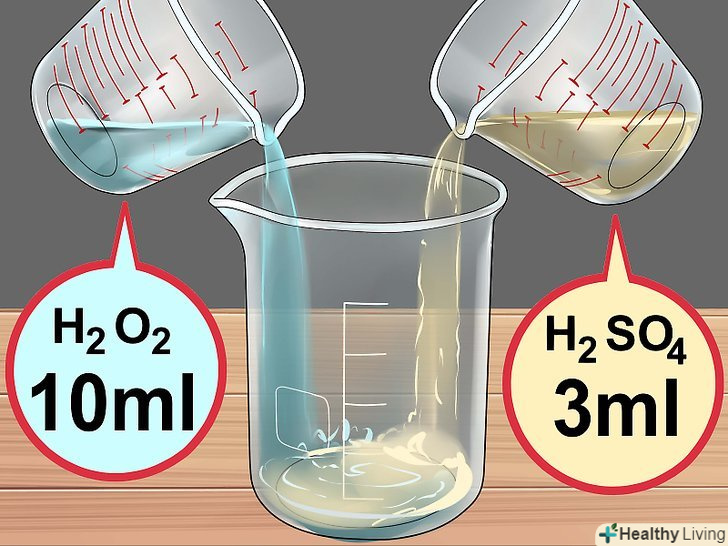
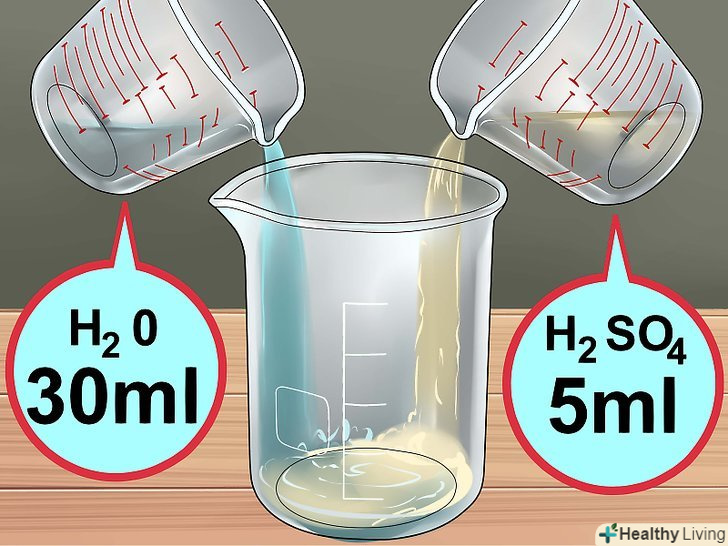
Зберіть необхідні матеріали.вам знадобляться 30% перекис (пероксид) водню і концентрована 98% сірчана кислота. Обидва реагенту можна замовити в звичайному або інтернет-магазині хімічних реактивів. Крім того, буде потрібно мідний дріт довжиною 7-10 сантиметрів або трохи Мідного брухту, які можна придбати в магазині господарських товарів.[4] Приготуйте розчин кислоти.налийте в хімічний стакан 10 мілілітрів 30% перекису водню, потім додайте в нього 3 мілілітра концентрованої сірчаної кислоти. У вас вийде так звана суміш "Піранья", яка швидко розігріється, так що будьте надзвичайно обережні.
Приготуйте розчин кислоти.налийте в хімічний стакан 10 мілілітрів 30% перекису водню, потім додайте в нього 3 мілілітра концентрованої сірчаної кислоти. У вас вийде так звана суміш "Піранья", яка швидко розігріється, так що будьте надзвичайно обережні.- Ні в якому разі не накривайте склянку або іншу посудину з даним розчином, так як він може вибухнути.
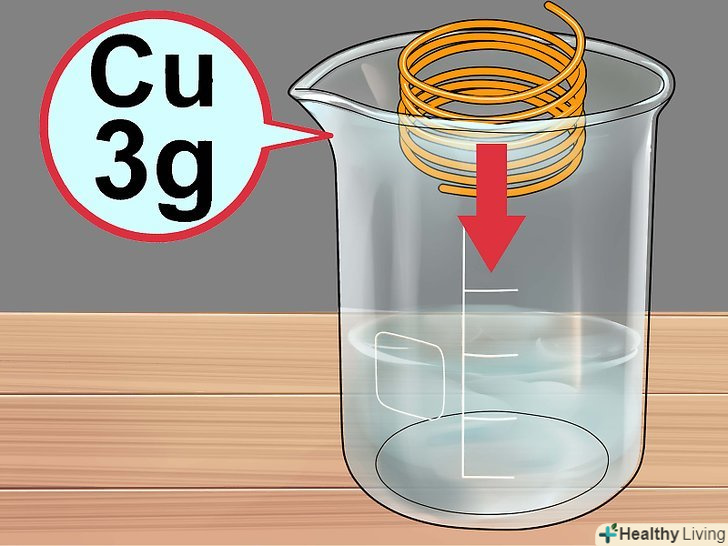
 Додайте мідь.обережно помістіть в розчин близько 3 грамів мідного дроту або брухту.
Додайте мідь.обережно помістіть в розчин близько 3 грамів мідного дроту або брухту.- Не використовуйте для експерименту мідні монети, так як в них, крім міді, містяться інші метали, що може привести до несподіваних реакцій.[5]
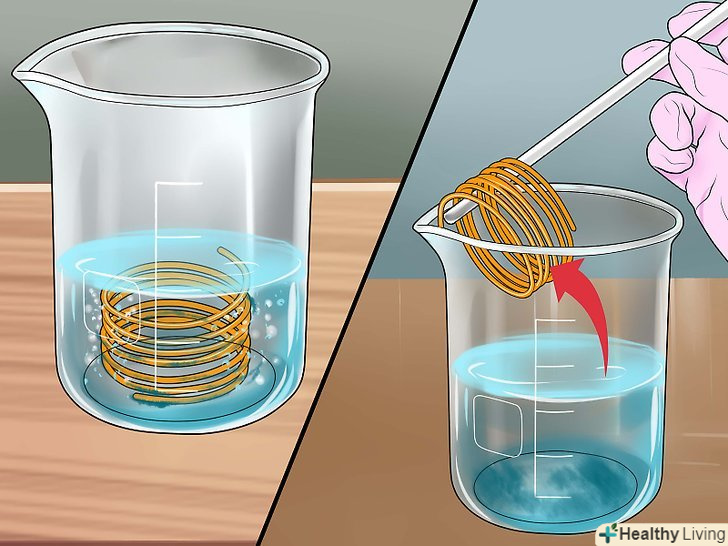
 Простежте за протіканням реакції.навколо міді почнуть утворюватися бульбашки газу, а перш прозора рідина поступово забарвиться в синій колір. Зачекайте до тих пір, поки перестануть виділятися бульбашки газу. Це може зайняти кілька хвилин, в залежності від температури і концентрації розчину. Потім скляною паличкою або лопаткою обережно видаліть з розчину залишилася мідь. В результаті у вас вийде Водний розчин сульфату міді.[6]
Простежте за протіканням реакції.навколо міді почнуть утворюватися бульбашки газу, а перш прозора рідина поступово забарвиться в синій колір. Зачекайте до тих пір, поки перестануть виділятися бульбашки газу. Це може зайняти кілька хвилин, в залежності від температури і концентрації розчину. Потім скляною паличкою або лопаткою обережно видаліть з розчину залишилася мідь. В результаті у вас вийде Водний розчин сульфату міді.[6] Випаруйте рідину.якщо ви хочете отримати сульфат міді в кристалічній формі, перелийте розчин в неглибоке скляне блюдце і залиште на повітрі на кілька днів, щоб з нього випарувалася рідина. При цьому пам'ятайте про те, що розчин зберігає свої їдкі властивості, і звертайтеся з ним обережно.[7] після цього ви зможете використовувати кристали сульфату міді для різних експериментів або виростити більші кристали.[8]
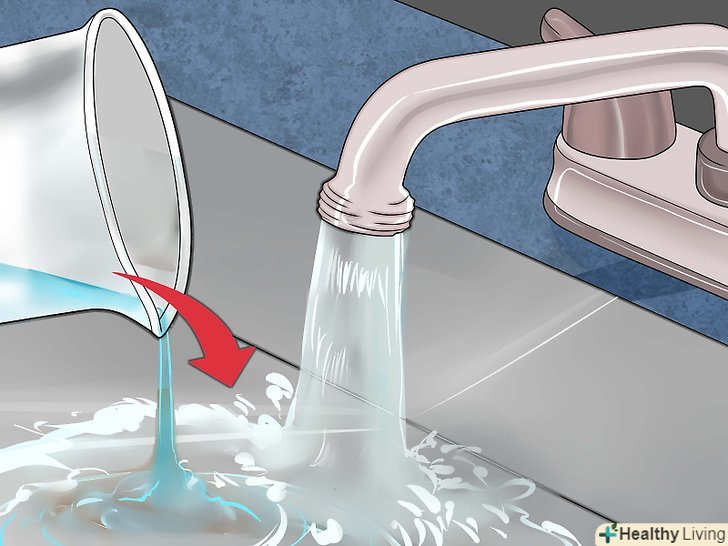
Випаруйте рідину.якщо ви хочете отримати сульфат міді в кристалічній формі, перелийте розчин в неглибоке скляне блюдце і залиште на повітрі на кілька днів, щоб з нього випарувалася рідина. При цьому пам'ятайте про те, що розчин зберігає свої їдкі властивості, і звертайтеся з ним обережно.[7] після цього ви зможете використовувати кристали сульфату міді для різних експериментів або виростити більші кристали.[8] Належним чином позбудьтеся від зайвого розчину сульфату міді.Сульфат міді токсичний для риб і рослин, він забруднює навколишнє середовище, тому його не слід виливати в річки, озера та інші природні водойми. При цьому сульфат міді входить до складу багатьох засобів для очищення водостічних труб, тому невелику кількість цієї речовини можна розбавити водою, вилити в раковину і як слід змити.
Належним чином позбудьтеся від зайвого розчину сульфату міді.Сульфат міді токсичний для риб і рослин, він забруднює навколишнє середовище, тому його не слід виливати в річки, озера та інші природні водойми. При цьому сульфат міді входить до складу багатьох засобів для очищення водостічних труб, тому невелику кількість цієї речовини можна розбавити водою, вилити в раковину і як слід змити.
Метод2 З 3:
Отримання сульфату міді за допомогою азотної кислоти
 Подбайте про техніку безпеки.азотна кислота становить значно більшу небезпеку, ніж сірчана, тому будьте дуже обережні.[9] вам знадобляться захисні окуляри, кислотостійкі рукавички і лабораторний халат.
Подбайте про техніку безпеки.азотна кислота становить значно більшу небезпеку, ніж сірчана, тому будьте дуже обережні.[9] вам знадобляться захисні окуляри, кислотостійкі рукавички і лабораторний халат. Виберіть відповідне робоче місце.оскільки азотна кислота дуже небезпечна, даний експеримент можна проводити тільки в лабораторних умовах. Так як при експерименті виділяються токсичні пари (газ NO2), його слід проводити під витяжкою.
Виберіть відповідне робоче місце.оскільки азотна кислота дуже небезпечна, даний експеримент можна проводити тільки в лабораторних умовах. Так як при експерименті виділяються токсичні пари (газ NO2), його слід проводити під витяжкою. Зберіть необхідні інструменти. вам знадобляться скляний хімічний стакан або гуртка, мензурка з міліметровою шкалою або скляна піпетка, скляна паличка або лопатка для того, щоб дістати зайву мідь, і ваги, щоб зважити мідь.
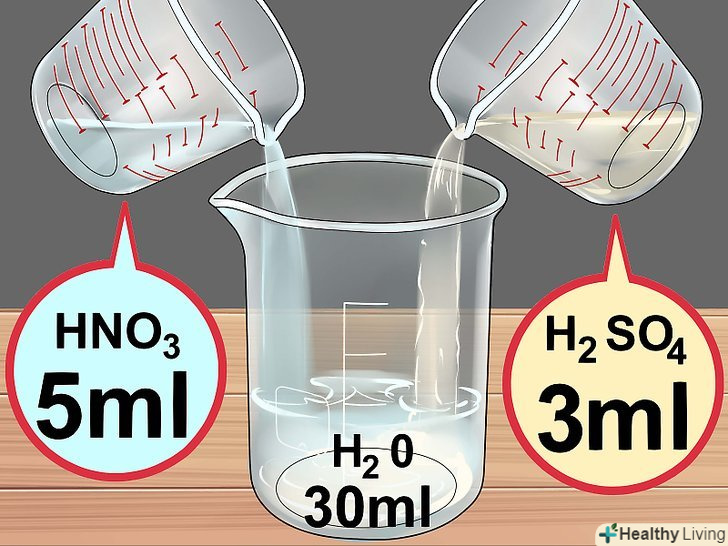
Зберіть необхідні інструменти. вам знадобляться скляний хімічний стакан або гуртка, мензурка з міліметровою шкалою або скляна піпетка, скляна паличка або лопатка для того, щоб дістати зайву мідь, і ваги, щоб зважити мідь. Зберіть необхідні матеріали.вам буде потрібно вода, азотна кислота (70%) і концентрована (98%) сірчана кислота. Ці реагенти можна придбати в магазині хімічних реактивів. Крім того, буде потрібно мідний дріт довжиною 7-10 сантиметрів або трохи Мідного брухту, які можна придбати в магазині господарських товарів.[10]
Зберіть необхідні матеріали.вам буде потрібно вода, азотна кислота (70%) і концентрована (98%) сірчана кислота. Ці реагенти можна придбати в магазині хімічних реактивів. Крім того, буде потрібно мідний дріт довжиною 7-10 сантиметрів або трохи Мідного брухту, які можна придбати в магазині господарських товарів.[10] Приготуйте розчин кислот.спочатку налийте в хімічний стакан 30 мілілітрів води, потім додайте 5 мілілітрів азотної кислоти і 3 мілілітри концентрованої сірчаної кислоти.[11]
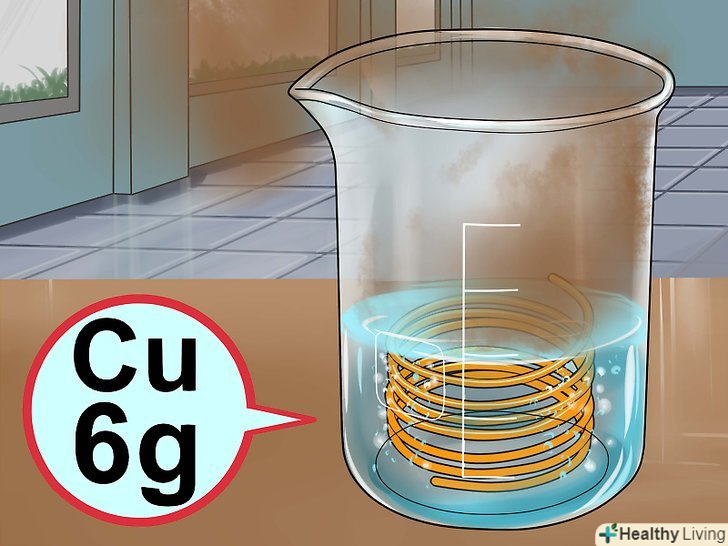
Приготуйте розчин кислот.спочатку налийте в хімічний стакан 30 мілілітрів води, потім додайте 5 мілілітрів азотної кислоти і 3 мілілітри концентрованої сірчаної кислоти.[11] Додайте мідь.обережно покладіть в розчин близько 6 грамів міді. Відступіть назад, щоб не дихати парами, і спостерігайте за реакцією. Ви побачите, як у міру розчинення міді в розчині виділяються бульбашки коричневого газу, і рідина забарвлюється в синій колір. Реакція завершиться, коли припиниться утворення бульбашок газу.[12]
Додайте мідь.обережно покладіть в розчин близько 6 грамів міді. Відступіть назад, щоб не дихати парами, і спостерігайте за реакцією. Ви побачите, як у міру розчинення міді в розчині виділяються бульбашки коричневого газу, і рідина забарвлюється в синій колір. Реакція завершиться, коли припиниться утворення бульбашок газу.[12]- Газ, що виділяється при реакції, токсичний, і його не слід вдихати.
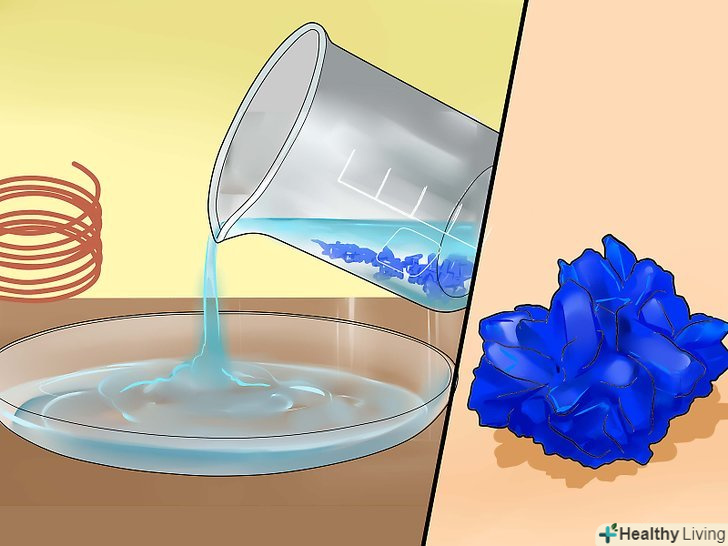
 Випаруйте рідину.якщо ви хочете отримати сульфат міді в кристалічній формі, перелийте розчин в неглибоке скляне блюдце і залиште на повітрі на кілька днів, щоб з нього випарувалася рідина. При цьому пам'ятайте про те, що розчин зберігає свої їдкі властивості, і звертайтеся з ним обережно.[13] після цього Ви зможете використовувати кристали сульфату міді для різних експериментів, або виростити більші кристали.[14]
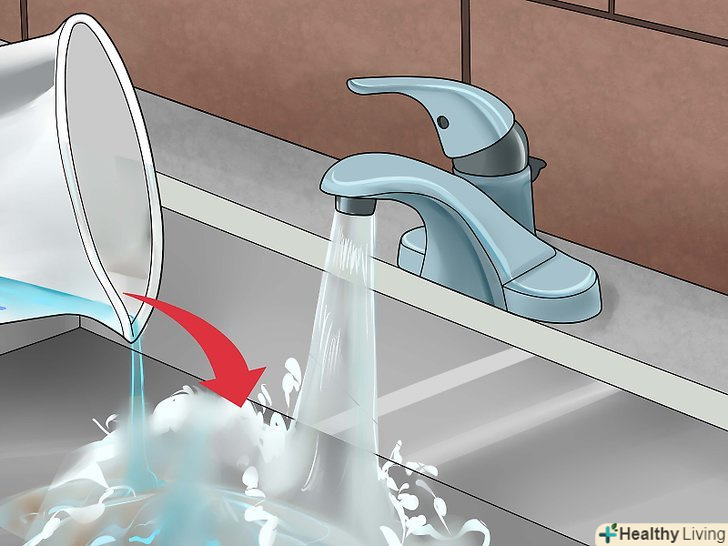
Випаруйте рідину.якщо ви хочете отримати сульфат міді в кристалічній формі, перелийте розчин в неглибоке скляне блюдце і залиште на повітрі на кілька днів, щоб з нього випарувалася рідина. При цьому пам'ятайте про те, що розчин зберігає свої їдкі властивості, і звертайтеся з ним обережно.[13] після цього Ви зможете використовувати кристали сульфату міді для різних експериментів, або виростити більші кристали.[14] Належним чином позбудьтеся від зайвого розчину сульфату міді.Сульфат міді токсичний для риб і рослин, він забруднює навколишнє середовище, тому його не слід виливати в річки, озера та інші природні водойми. При цьому сульфат міді входить до складу багатьох засобів для очищення водостічних труб, тому невелику кількість цієї речовини можна розбавити водою, вилити в раковину і як слід змити.
Належним чином позбудьтеся від зайвого розчину сульфату міді.Сульфат міді токсичний для риб і рослин, він забруднює навколишнє середовище, тому його не слід виливати в річки, озера та інші природні водойми. При цьому сульфат міді входить до складу багатьох засобів для очищення водостічних труб, тому невелику кількість цієї речовини можна розбавити водою, вилити в раковину і як слід змити.
Метод3 З 3:
Отримання сульфату міді електролітичним шляхом
 Подбайте про техніку безпеки.вам знадобляться захисні окуляри, лабораторний халат або щільна сорочка з довгими рукавами, щоб захиститися від можливих бризок, а також кислотостійкі рукавички з латексу або нітрилу. Слід також запастися пачкою харчової соди (бікарбонату натрію), щоб при необхідності нейтралізувати кислоту.
Подбайте про техніку безпеки.вам знадобляться захисні окуляри, лабораторний халат або щільна сорочка з довгими рукавами, щоб захиститися від можливих бризок, а також кислотостійкі рукавички з латексу або нітрилу. Слід також запастися пачкою харчової соди (бікарбонату натрію), щоб при необхідності нейтралізувати кислоту.- Сірчана кислота дуже агресивна. Будьте обережні і не пролийте або не розбризкуйте її.
- Якщо на вашу шкіру потрапить сірчана кислота, відразу ж промийте її холодною водою з милом протягом хоча б 15 хвилин, після чого зверніться за медичною допомогою.
- Якщо сірчана кислота потрапить в очі, промийте їх холодною водою протягом хоча б 30 хвилин, після чого зверніться за медичною допомогою. Щоб цього не сталося, надіньте захисні окуляри!
 Виберіть відповідне робоче місце.при даному експерименті буде виділятися надзвичайно вибухонебезпечний газоподібний водень (H2), тому його слід проводити на відкритому повітрі або під витяжкою, далеко від джерел відкритого вогню або легкозаймистих предметів. Необхідно також розмістити все обладнання на кислототривкої, бажано скляної або іншої хімічно стійкої поверхні.[15]
Виберіть відповідне робоче місце.при даному експерименті буде виділятися надзвичайно вибухонебезпечний газоподібний водень (H2), тому його слід проводити на відкритому повітрі або під витяжкою, далеко від джерел відкритого вогню або легкозаймистих предметів. Необхідно також розмістити все обладнання на кислототривкої, бажано скляної або іншої хімічно стійкої поверхні.[15]- Якщо у вас немає хімічно стійкої поверхні, слід принаймні застелити робоче місце листом товстого картону. При попаданні на картон сірчана кислотаобов'язково почне розчиняти його, однак це займе деякий час, протягом якого ви встигнете нейтралізувати її харчовою содою, перш ніж вона роз'їсть картон наскрізь.
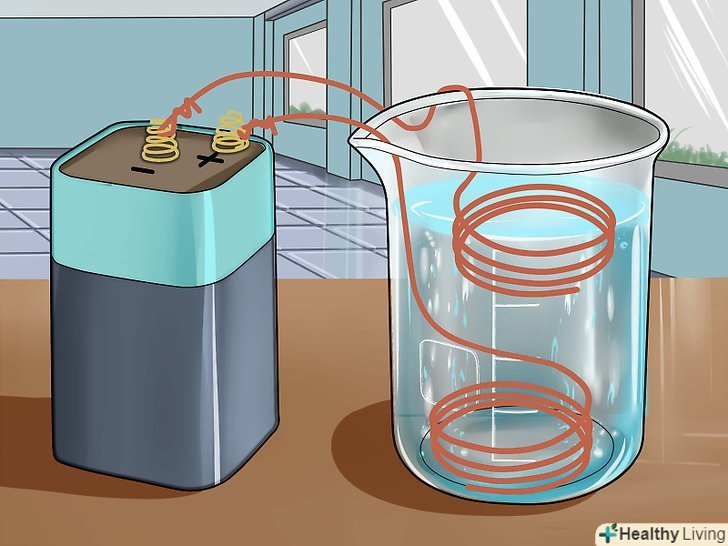
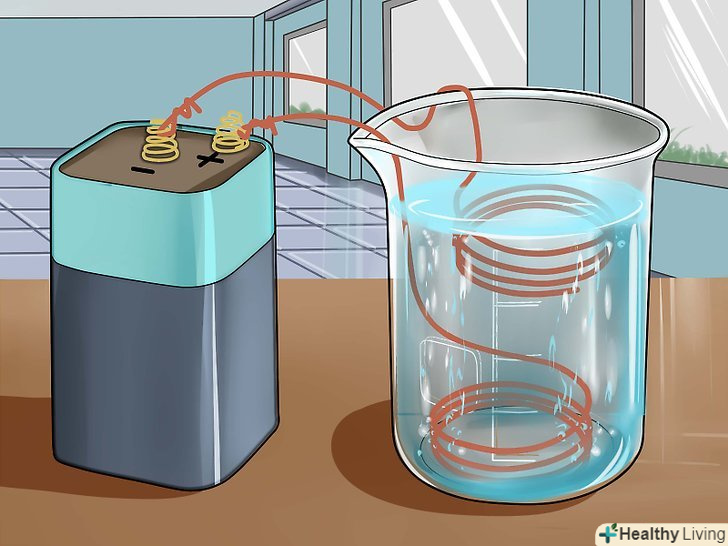
 Зберіть необхідні матеріали та інструменти.вам знадобиться 6-вольтова батарея, скляний хімічний стакан або кружка, 2 мідних зволікання, концентрована сірчана кислота (її можна придбати в магазині хімічних реактивів), скляна мірна мензурка або піпетка і вода.
Зберіть необхідні матеріали та інструменти.вам знадобиться 6-вольтова батарея, скляний хімічний стакан або кружка, 2 мідних зволікання, концентрована сірчана кислота (її можна придбати в магазині хімічних реактивів), скляна мірна мензурка або піпетка і вода.- Якщо у вас немає концентрованої сірчаної кислоти, можна використовувати акумуляторну кислоту, яку можна придбати в магазині господарських товарів або автомагазині. В акумуляторній кислоті міститься 30-35% сірчаної кислоти.
 Приготуйте розчин сірчаної кислоти.налийте в хімічний стакан 30 мілілітрів води і 5 мілілітрів концентрованої сірчаної кислоти. Якщо ви використовуєте менш концентровану акумуляторну кислоту, додайте 15 мілілітрів цієї кислоти в 20 мілілітрів води.
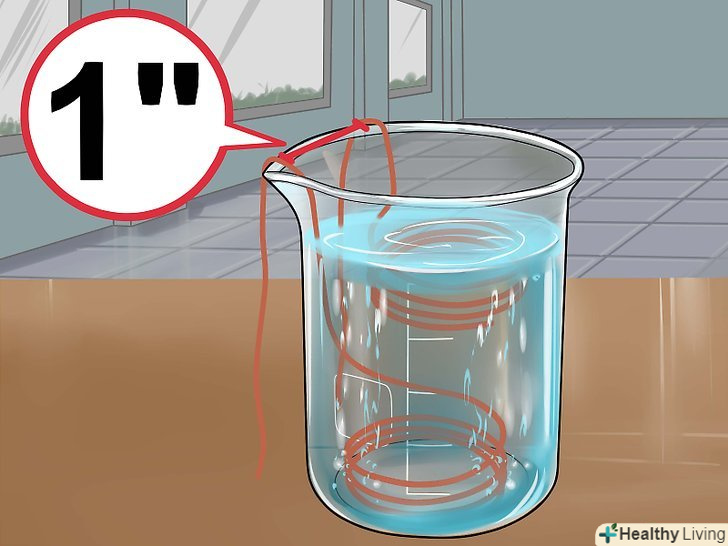
Приготуйте розчин сірчаної кислоти.налийте в хімічний стакан 30 мілілітрів води і 5 мілілітрів концентрованої сірчаної кислоти. Якщо ви використовуєте менш концентровану акумуляторну кислоту, додайте 15 мілілітрів цієї кислоти в 20 мілілітрів води. Занурте в розчин дві зволікання так, щоб вони не торкалися один одного.зволікання повинні знаходитися на відстані близько 2,5 сантиметра один від одного (в залежності від розмірів ємності). Слідкуйте, щоб вони не стикалися.[16]
Занурте в розчин дві зволікання так, щоб вони не торкалися один одного.зволікання повинні знаходитися на відстані близько 2,5 сантиметра один від одного (в залежності від розмірів ємності). Слідкуйте, щоб вони не стикалися.[16] Підключіть зволікання до 6-вольтової батареї.Одну зволікання слід оповити навколо позитивної клеми, а другу підключити до негативної клеми батареї.
Підключіть зволікання до 6-вольтової батареї.Одну зволікання слід оповити навколо позитивної клеми, а другу підключити до негативної клеми батареї. Простежте за реакцією. ви побачите, як на аноді (зволікання, приєднаної до негативної клеми) виділяються бульбашки газу. При цьому газ не повинен виділятися на катоді. У міру утворення сульфату міді розчин забарвиться в синій колір. Зачекайте, поки реакція завершиться і розчин остаточно посиніє, після чого вийміть зволікання з рідини і від'єднайте їх від батареї.
Простежте за реакцією. ви побачите, як на аноді (зволікання, приєднаної до негативної клеми) виділяються бульбашки газу. При цьому газ не повинен виділятися на катоді. У міру утворення сульфату міді розчин забарвиться в синій колір. Зачекайте, поки реакція завершиться і розчин остаточно посиніє, після чого вийміть зволікання з рідини і від'єднайте їх від батареї. Випаруйте рідину.якщо ви хочете отримати сульфат міді в кристалічній формі, перелийте розчин в неглибоке скляне блюдце і залиште на повітрі на кілька днів, щоб з нього випарувалася рідина. Можна прискорити процес і обережно закип'ятити розчин у вогнетривкій посуді з пірексу або боросилікату, а потім зцідити залишки неіспарившейся сірчаної кислоти. При цьому пам'ятайте про те, що розчин зберігає свої їдкі властивості, і звертайтеся з ним обережно.
Випаруйте рідину.якщо ви хочете отримати сульфат міді в кристалічній формі, перелийте розчин в неглибоке скляне блюдце і залиште на повітрі на кілька днів, щоб з нього випарувалася рідина. Можна прискорити процес і обережно закип'ятити розчин у вогнетривкій посуді з пірексу або боросилікату, а потім зцідити залишки неіспарившейся сірчаної кислоти. При цьому пам'ятайте про те, що розчин зберігає свої їдкі властивості, і звертайтеся з ним обережно. Належним чином позбудьтеся від зайвого розчину сульфату міді.Сульфат міді токсичний для риб і рослин, він забруднює навколишнє середовище, тому його не слід виливати в річки, озера та інші природні водойми. При цьому сульфат міді входить до складу багатьох засобів для очищення водостічних труб, тому невелику кількість цієї речовини можна розбавити водою, вилити в раковину і як слід змити.
Належним чином позбудьтеся від зайвого розчину сульфату міді.Сульфат міді токсичний для риб і рослин, він забруднює навколишнє середовище, тому його не слід виливати в річки, озера та інші природні водойми. При цьому сульфат міді входить до складу багатьох засобів для очищення водостічних труб, тому невелику кількість цієї речовини можна розбавити водою, вилити в раковину і як слід змити.
Джерела
- ↑ Http://www.copper.org/resources/properties/compounds/table_a.html
- ↑ Https://www.tamut.edu/About/Administration/Environmental-Health-and-Safety/Information%20Folder/Chemical%20disposal.pdf
- ↑ Https://www.youtube.com/watch?v=L7xr6GqGnrw
- ↑ Https://www.youtube.com/watch?v=arlYPz3EP7A
- ↑ Http://www.livescience.com/32401-whats-a-penny-made-of.html
- ↑ http://www.nuffieldfoundation.org/practical-chemistry/reacting-copperii-oxide-sulfuric-acid
- ↑ Http://sciencenotes.org/how-to-grow-blue-copper-sulfate-crystals/
- ↑ Http://sciencenotes.org/how-to-grow-blue-copper-sulfate-crystals/
- ↑ Http://www.cdc.gov/niosh/npg/npgd0447.html
- ↑ Https://www.youtube.com/watch?v=arlYPz3EP7A
- ↑ https://www.youtube.com/watch?v=arlYPz3EP7A
- ↑ Http://www.angelo.edu/faculty/kboudrea/demos/copper_HNO3/Cu_HNO3.htm
- ↑ Http://sciencenotes.org/how-to-grow-blue-copper-sulfate-crystals/
- ↑ Http://sciencenotes.org/how-to-grow-blue-copper-sulfate-crystals/
- ↑ Https://www.youtube.com/watch?v=L7xr6GqGnrw
- ↑ https://www.youtube.com/watch?v=arlYPz3EP7A