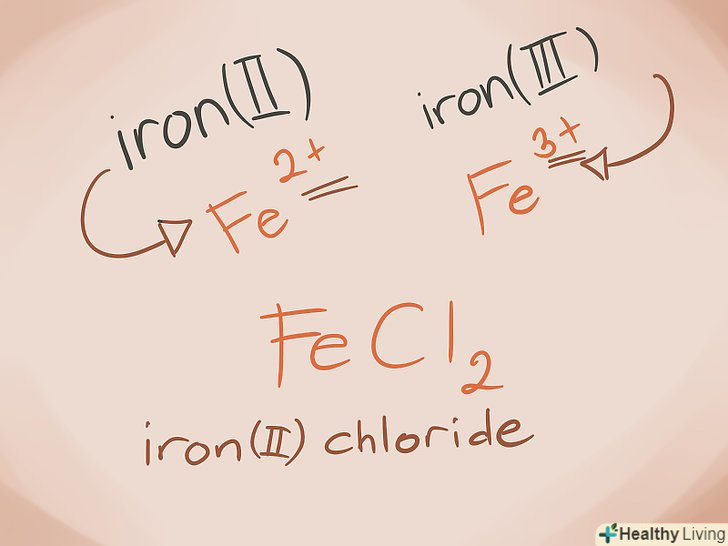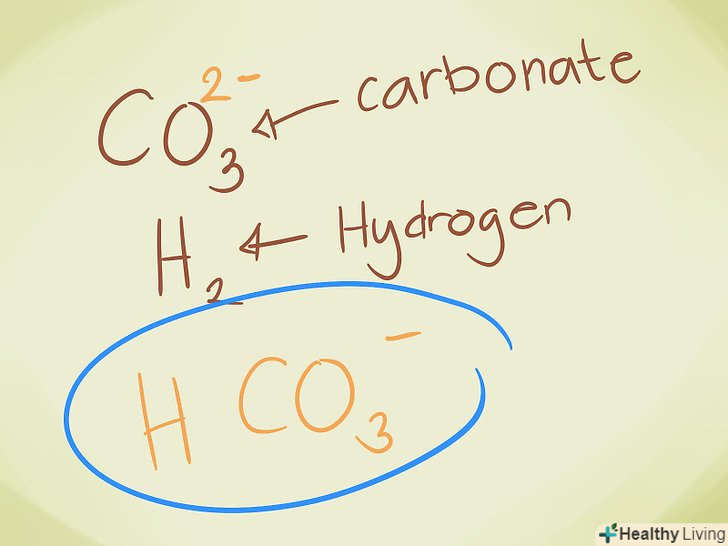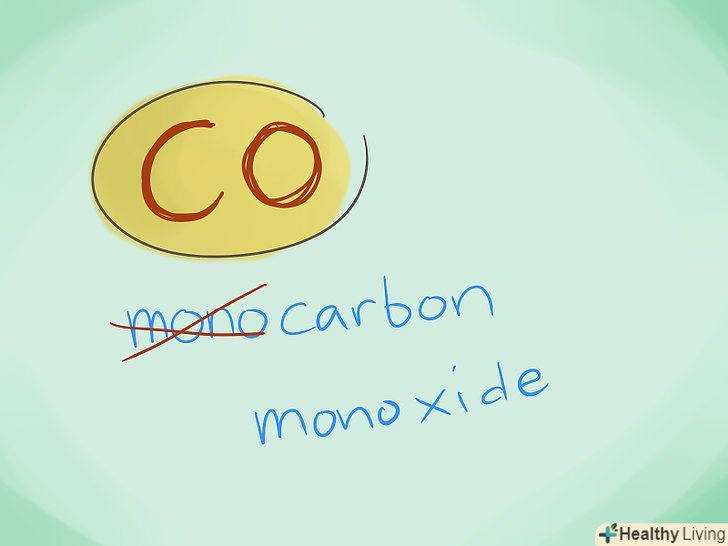Уміння давати назви основним хімічним сполукам-необхідна складова успішного вивчення хімії. Дотримуйтесь цього посібника, щоб дізнатися деякі базові правила присвоєння назв хімічним сполукам, а також навчитися називати хімічні сполуки, які ви побачили вперше.
Кроки
Метод1З 3:
Назва іонних сполук
Метод1З 3:
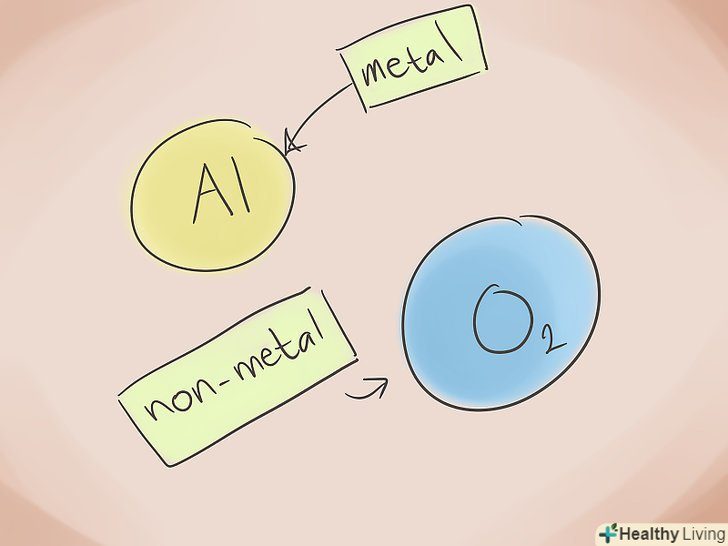
 З'ясуйте, що робить з'єднання іонним. Іонні сполуки містять метал і металоїд. Погляньте на періодичну систему і подивіться, до якої категорії відносяться елементи з'єднання.
З'ясуйте, що робить з'єднання іонним. Іонні сполуки містять метал і металоїд. Погляньте на періодичну систему і подивіться, до якої категорії відносяться елементи з'єднання. Складіть ім'я.назвати двоелементне іонне з'єднання легко. Перша частина назви-це назва елемента-неметалла з суфіксом" - Ід". Друга частина назви - це назва елемента-металу в родовому відмінку.
Складіть ім'я.назвати двоелементне іонне з'єднання легко. Перша частина назви-це назва елемента-неметалла з суфіксом" - Ід". Друга частина назви - це назва елемента-металу в родовому відмінку.- Приклад: Al2O3 . Al2 = алюміній; O3 = кисень (Оксиген). Відповідно, назва цієї сполуки - "оксид алюмінію".
 Навчіться визначати метали змінної валентності.метали в блоках D і F періодичної системи називаються металами змінної валентності. При складанні назви з'єднання їх валентність пишеться як римська цифра. Це пояснюється тим, що вони можуть мати більше однієї валентності, і що вони можуть утворювати більше однієї сполуки з іншим атомом.
Навчіться визначати метали змінної валентності.метали в блоках D і F періодичної системи називаються металами змінної валентності. При складанні назви з'єднання їх валентність пишеться як римська цифра. Це пояснюється тим, що вони можуть мати більше однієї валентності, і що вони можуть утворювати більше однієї сполуки з іншим атомом.- Приклад: FeCl2 і FeCl3 . Fe = залізо; Cl2 = Хлорид -2; Cl3 = Хлорид -3. Назва буде виглядати так: хлорид заліза (II) і хлорид заліза (III).
Метод2 З 3:
Назви багатоатомних сполук
Метод2 З 3:
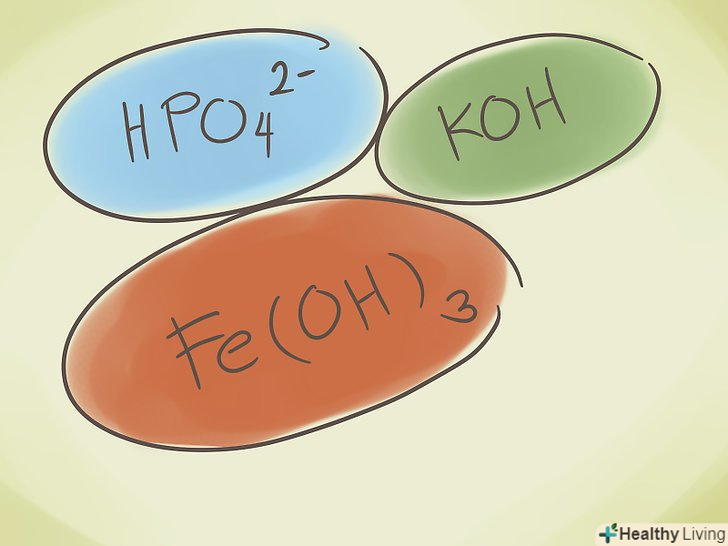
 З'ясуйте, що таке багатоатомне з'єднання.ці сполуки складаються з груп атомів, пов'язаних один з одним, причому вся група має позитивний або негативний заряд. Ви можете виконувати з багатоатомними сполуками три базові операції:
З'ясуйте, що таке багатоатомне з'єднання.ці сполуки складаються з груп атомів, пов'язаних один з одним, причому вся група має позитивний або негативний заряд. Ви можете виконувати з багатоатомними сполуками три базові операції:- Додавати атом водню в початок з'єднання. Тоді в початок назви з'єднання додається слово "Гідро". Це знижує негативний заряд на одиницю. Наприклад," карбонат "CO32- перетвориться в" гідрокарбонат " HCO3-.

- Прибирати атом кисню із з'єднання. Заряд залишиться таким же, а закінчення назви з'єднання зміниться з "-ат" на "-ІТ". Наприклад: перехід від NO3 до NO2 - це перехід від "нітрату" до "нітриту".

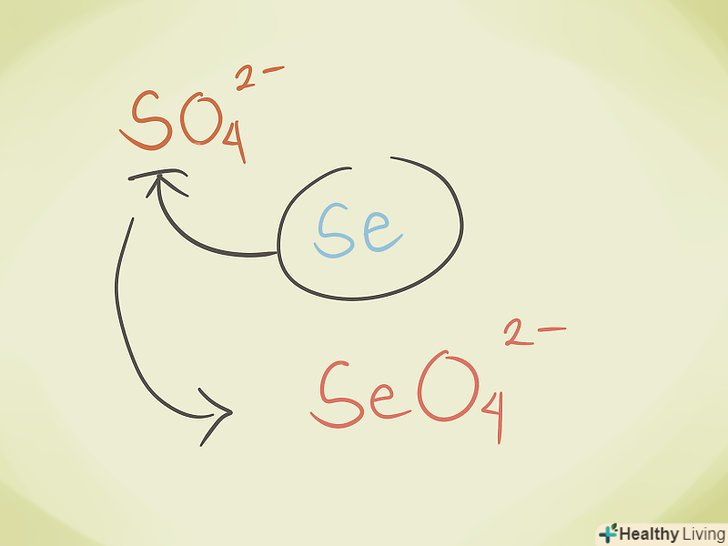
- Замінювати центральний атом іншим з тієї ж групи періодичної системи. Наприклад, сульфат SO42- може стати селенатом42-.

- Додавати атом водню в початок з'єднання. Тоді в початок назви з'єднання додається слово "Гідро". Це знижує негативний заряд на одиницю. Наприклад," карбонат "CO32- перетвориться в" гідрокарбонат " HCO3-.
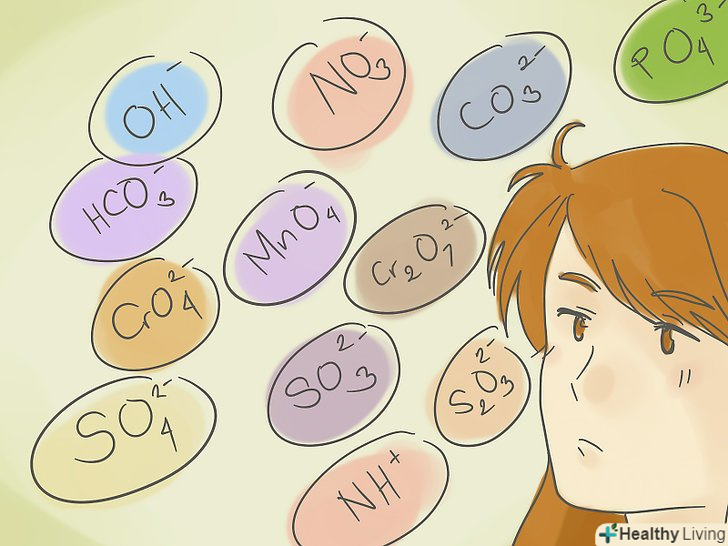
 Запам'ятайте найбільш часто зустрічаються складні іони.дані іони-база для формування більшості назв багатоатомних сполук. Вони наведені нижче в порядку зростання негативного заряду:
Запам'ятайте найбільш часто зустрічаються складні іони.дані іони-база для формування більшості назв багатоатомних сполук. Вони наведені нижче в порядку зростання негативного заряду:- Гідроксид-іон: OH -
- Нітрат-іон: NO3 -
- Гідрокарбонат-іон: HCO3 -
- Перманганат-іон: MnO4 -
- Карбонат-іон: CO32 -
- Хромат-іон: CrO42 -
- Дихромат-іон: Cr2O72 -
- Сульфат-іон: SO4 2 -
- Сульфіт-іон: SO3 2 -
- Тіосульфат-іон: S2O32 -
- Фосфат-іон: PO43 -
- Іон амонію: NH4 +
- Складайте назви з'єднань на основі даного списку. Об'єднайте назву будь-якого елемента або елементів, пов'язаних зі складним іоном, і назвіть з'єднання. Якщо елемент стоїть перед складним іоном, назва елемента просто ставиться після назви іона.
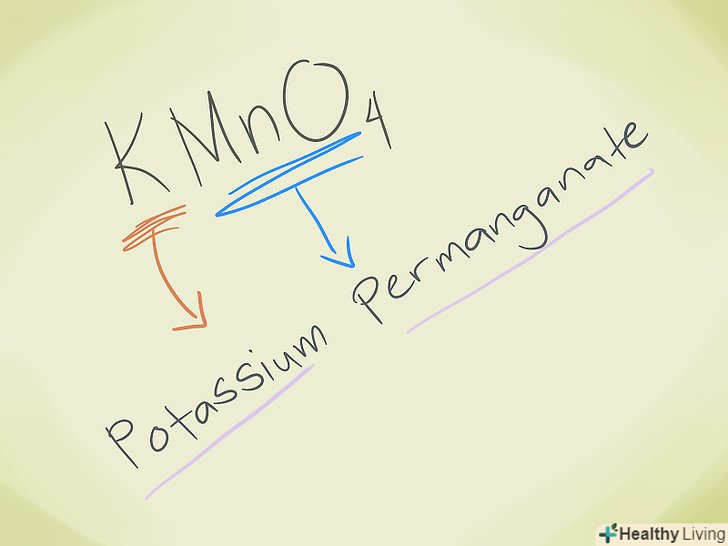
- Приклад: KMnO4. Ми бачимо, що іон MnO4- - це перманганат. K-це калій, тому назва сполуки-перманганат калію.

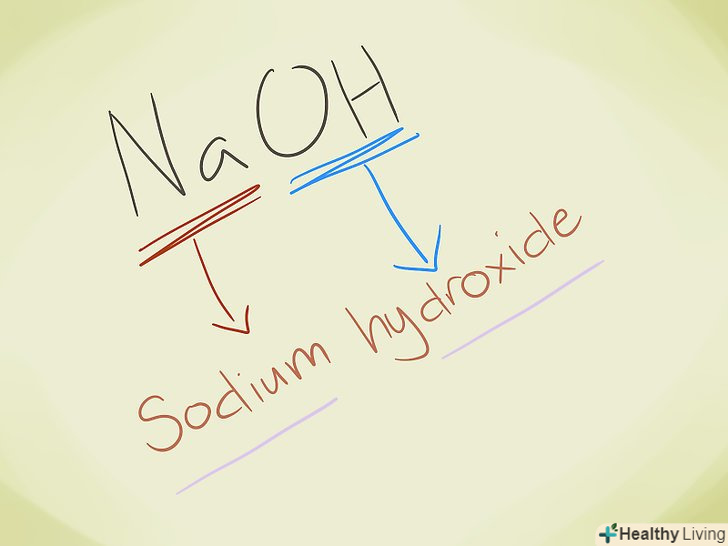
- Приклад: NaOH. Ми бачимо, що OH - - це гідроксид-іон. Na-це натрій, тому назва сполуки-гідроксид натрію.

- Приклад: KMnO4. Ми бачимо, що іон MnO4- - це перманганат. K-це калій, тому назва сполуки-перманганат калію.
Метод3 З 3:
Назви ковалентних сполук
Метод3 З 3:
 З'ясуйте, що таке ковалентне з'єднання.ковалентні сполуки утворюються з двох або більше елементів-неметалів. Ім'я з'єднання базується на кількості присутніх атомів. Доданий префікс-це латинське числівник, що характеризує кількість молекул.
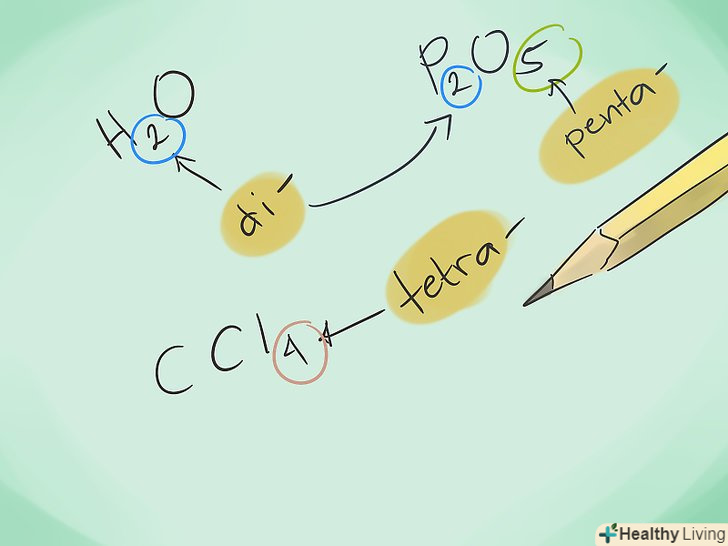
З'ясуйте, що таке ковалентне з'єднання.ковалентні сполуки утворюються з двох або більше елементів-неметалів. Ім'я з'єднання базується на кількості присутніх атомів. Доданий префікс-це латинське числівник, що характеризує кількість молекул. Вивчіть префікси.Запам'ятайте префікси для позначення кількості атомів від 1 до 8:
Вивчіть префікси.Запам'ятайте префікси для позначення кількості атомів від 1 до 8:- 1 атом-“Моно - "
- 2 атома-“Ді - "
- 3 атома-“Три - "
- 4 атома-“Тетра - "
- 5 атомів-“Пента - "
- 6 атомів-“Гекса - "
- 7 атомів-“Гепта - "
- 8 атомів-“Окта - "
- Називайте з'єднання. використовуючи відповідні префікси, назвіть нове з'єднання. Ви можете додавати префікс до будь-якої частини з'єднання, в якому є кілька атомів.
- Приклад: CO-це монооксид вуглецю, а CO2 діоксид вуглецю.

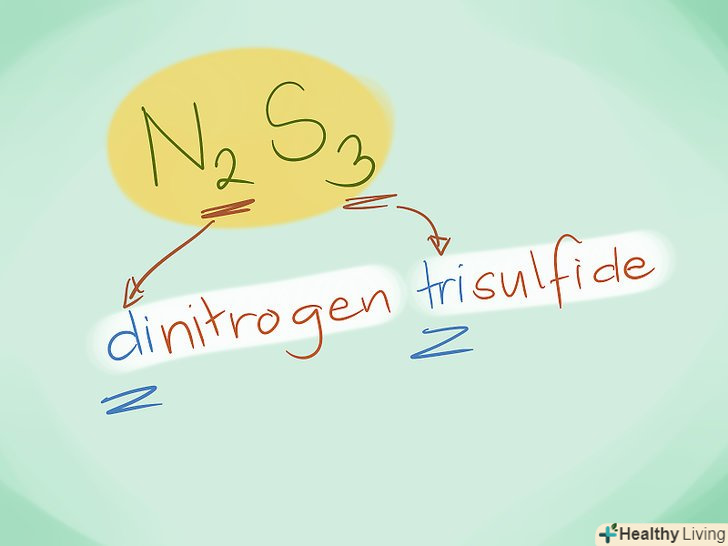
- Приклад: N2S3 - це трисульфід діазоту.

- У більшості випадків префікс "моно -" можна не використовувати, оскільки при відсутності префіксів мається на увазі саме він. Однак цей префікс досі використовується для монооксиду вуглецю у зв'язку з використанням цього терміна з часів ранньої хімії.

- Приклад: CO-це монооксид вуглецю, а CO2 діоксид вуглецю.
Поради
- Звичайно ж, у цих правил є безліч винятків. Наприклад, незважаючи на те, що CaCl2 має два атоми хлору, він називається хлоридом кальцію, а не дихлоридом кальцію, як можна було б очікувати.
- Також важливо розуміти, що все це не відноситься до органічної хімії.
- Ці правила призначені для людей, які починають вивчати хімію та науку. Коли ви досягнете просунутого рівня, ви дізнаєтеся, що існують інші правила, наприклад правило змінної валентності.