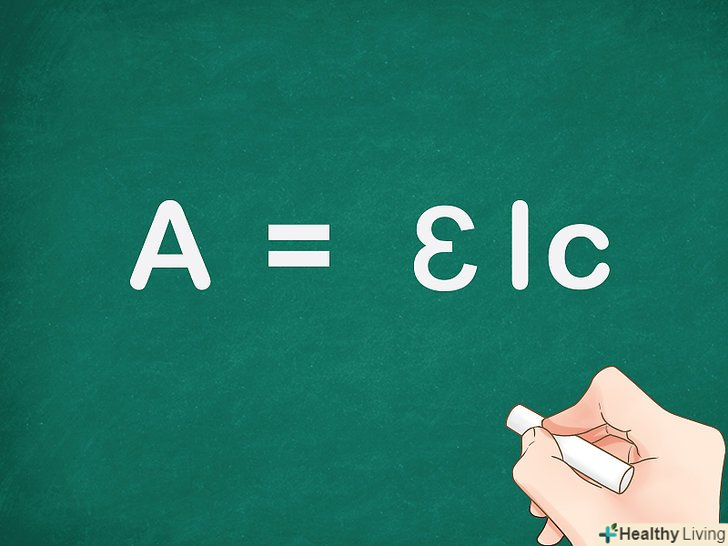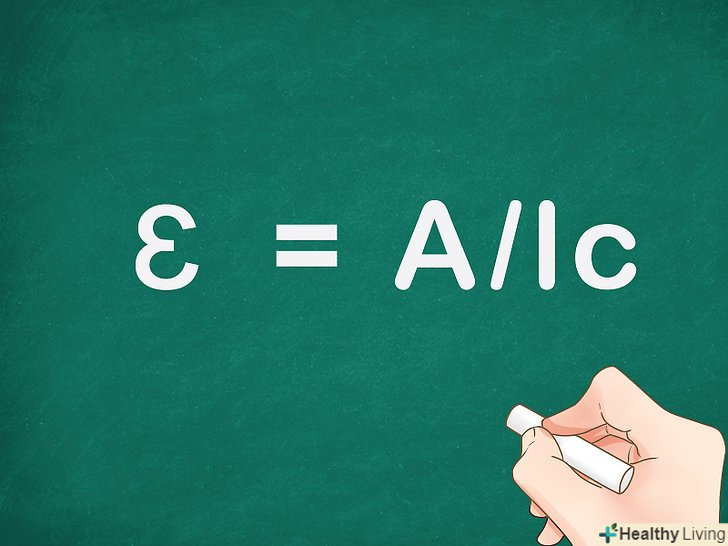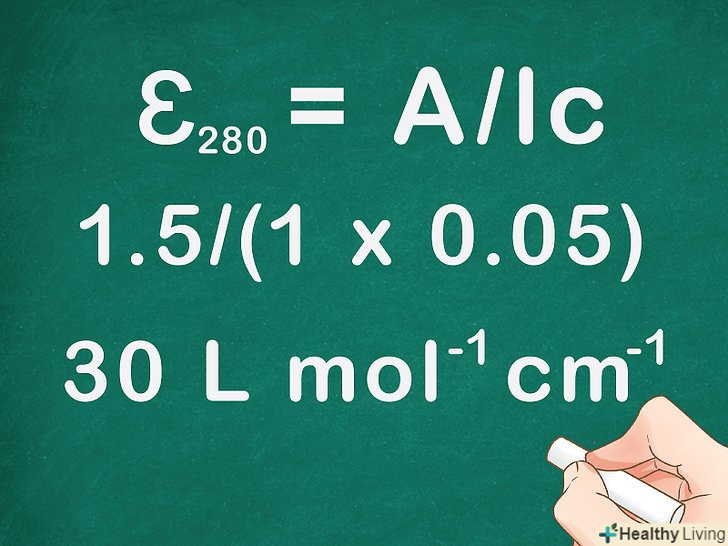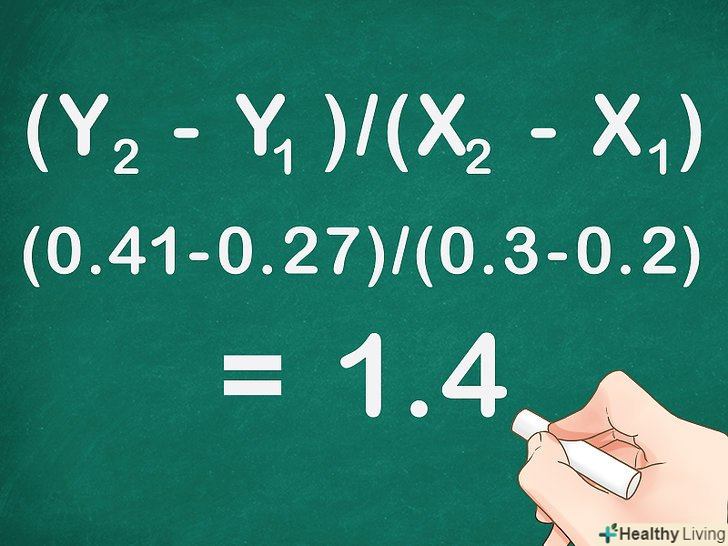Молярний коефіцієнт поглинання, також відомий як молярний коефіцієнт екстинкції, є мірою того, наскільки сильно хімічні частинки (молекули) тієї чи іншої речовини поглинають світло з певною довжиною хвилі. Кожна речовина характеризується своїм молярним коефіцієнтом поглинання, який не залежить від концентрації і обсягу.[1] ця характеристика широко використовується в хімії, і її не слід плутати з коефіцієнтом екстинкції, який частіше застосовується у фізиці. Стандартною одиницею вимірювання молярного коефіцієнта поглинання є літр, поділений на моль і на сантиметр (л моль-1 см-1).[2]
Кроки
Метод1 З 2:
Обчислення молярного коефіцієнта поглинання за формулою
Метод1 З 2:
 Ознайомтеся з законом Бугера-Ламберта-Бера:a = ɛlc . Поглинання світла в середовищі описується рівнянням a = ɛlc, де a - кількість світла певної довжини хвилі, який був поглинений зразком, ɛ — молярний коефіцієнт поглинання, l — відстань, пройдену світлом в розчині, і c - концентрація розчину (кількість досліджуваних молекул в одиниці об'єму).[3]
Ознайомтеся з законом Бугера-Ламберта-Бера:a = ɛlc . Поглинання світла в середовищі описується рівнянням a = ɛlc, де a - кількість світла певної довжини хвилі, який був поглинений зразком, ɛ — молярний коефіцієнт поглинання, l — відстань, пройдену світлом в розчині, і c - концентрація розчину (кількість досліджуваних молекул в одиниці об'єму).[3]- Коефіцієнт поглинання можна також знайти З співвідношення між інтенсивностями світла, що пройшов через еталон і досліджуваний зразок. У цьому випадку рівняння має такий вигляд:a = log10(Io/I).[4]
- Інтенсивність світла визначають за допомогою спектрофотометра.
- Поглинаюча здатність розчину залежить від довжини хвилі проходить через нього світла. При певних значеннях довжини хвилі світло поглинається сильніше, ніж при інших, і ці значення залежать від складу розчину. При розрахунках не забудьте вказати, для якої довжини хвилі вони зроблені.[5]
 Перетворіть закон Бугера-Ламберта-Бера так, щоб висловити молярний коефіцієнт поглинання. поділіть обидві частини рівняння на довжину і концентрацію, і в результаті ви отримаєте вираз для молярного коефіцієнта поглинання: ɛ = A/lc. За допомогою цієї формули можна обчислити молярний коефіцієнт поглинання для певної довжини хвилі.
Перетворіть закон Бугера-Ламберта-Бера так, щоб висловити молярний коефіцієнт поглинання. поділіть обидві частини рівняння на довжину і концентрацію, і в результаті ви отримаєте вираз для молярного коефіцієнта поглинання: ɛ = A/lc. За допомогою цієї формули можна обчислити молярний коефіцієнт поглинання для певної довжини хвилі.- Поглинальна здатність на фіксованій відстані залежить від концентрації розчину і форми використовуваної ємності. Молярний коефіцієнт поглинання дозволяє виключити ці фактори.[6]
 Виміряйте необхідні величини за допомогою спектрофотометрії.у спектрофотометрі світло з певною довжиною хвилі пропускається через речовину, і на виході вимірюється інтенсивність минулого світла. Частина світла поглинається розчином, і інтенсивність світла зменшується. Спектрофотометр дозволяє визначити інтенсивність минулого світла, яка використовується для розрахунку молярного коефіцієнта поглинання.
Виміряйте необхідні величини за допомогою спектрофотометрії.у спектрофотометрі світло з певною довжиною хвилі пропускається через речовину, і на виході вимірюється інтенсивність минулого світла. Частина світла поглинається розчином, і інтенсивність світла зменшується. Спектрофотометр дозволяє визначити інтенсивність минулого світла, яка використовується для розрахунку молярного коефіцієнта поглинання.- Приготуйте для аналізу розчин відомоїконцентрації c. Визначте концентрацію в одиницях моль / грам або моль/літр.[7]
- Для визначенняl виміряйте довжину використовуваної кювети. Запишіть довжину в сантиметрах.
- За допомогою спектрофотометра виміряйте поглинальну здатністьa для певної довжини хвилі. Довжина хвилі вимірюється в метрах, проте світло має настільки малі довжини хвиль, що вони виражаються зазвичай в нанометрах (нм).[8] поглинальна здатність є безрозмірною величиною.
 Підставте в рівняння чисельні значення і знайдіть молярний коефіцієнт поглинання. Візьміть чисельні значенняa ,c Іl і підставте їх у формулуɛ = A/lc . Помножте lна C, а потім поділіть a на цю величину, щоб знайти молярний коефіцієнт поглинання.
Підставте в рівняння чисельні значення і знайдіть молярний коефіцієнт поглинання. Візьміть чисельні значенняa ,c Іl і підставте їх у формулуɛ = A/lc . Помножте lна C, а потім поділіть a на цю величину, щоб знайти молярний коефіцієнт поглинання.- Припустимо, ви виміряли поглинальну здатність розчину концентрацією 0,05 моль / літр, використовуючи кювету довжиною 1 сантиметр. При цьому поглинальна здатність склала 1,5 для світла з довжиною хвилі 280 нм. Як знайти молярний коефіцієнт поглинання для даного розчину?
- ɛ280 = A / lc = 1,5/(1 x 0,05) = 30 л моль-1 см-1
- Припустимо, ви виміряли поглинальну здатність розчину концентрацією 0,05 моль / літр, використовуючи кювету довжиною 1 сантиметр. При цьому поглинальна здатність склала 1,5 для світла з довжиною хвилі 280 нм. Як знайти молярний коефіцієнт поглинання для даного розчину?
Метод2 З 2:
Знаходження молярного коефіцієнта поглинання графічним методом
Метод2 З 2:
 Виміряйте інтенсивність минулого світла для різних концентрацій розчину. приготуйте 3-4 розчину з різними концентраціями. За допомогою спектрофотометра виміряйте поглинальну здатність розчинів різної концентрації для даної довжини хвилі. Можна почати з розчину з найнижчою концентрацією. Порядок не важливий, головне не переплутати і записати виміряні величини поглинальної здатності відповідно до концентраціями.
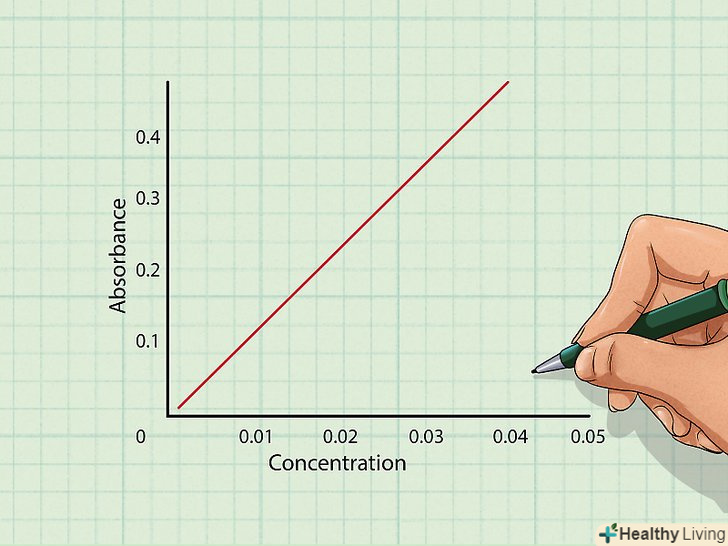
Виміряйте інтенсивність минулого світла для різних концентрацій розчину. приготуйте 3-4 розчину з різними концентраціями. За допомогою спектрофотометра виміряйте поглинальну здатність розчинів різної концентрації для даної довжини хвилі. Можна почати з розчину з найнижчою концентрацією. Порядок не важливий, головне не переплутати і записати виміряні величини поглинальної здатності відповідно до концентраціями. Нанесіть отримані значення на графік. відкладіть по горизонтальній осі X концентрацію, а по вертикальній Y-поглинальну здатність, і нанесіть на графік результати вимірювань у вигляді точок.[9]
Нанесіть отримані значення на графік. відкладіть по горизонтальній осі X концентрацію, а по вертикальній Y-поглинальну здатність, і нанесіть на графік результати вимірювань у вигляді точок.[9]- Проведіть між точками лінію. Якщо вимірювання були виконані правильно, точки повинні лягти на пряму лінію, оскільки, згідно із законом Бугера-Ламберта-Бера, поглинальна здатність прямо пропорційна концентрації.[10]
 ВизначтеНахил прямої, що проходить через експериментальні точки. щоб знайти кутовий коефіцієнт прямої, слід поділити прирощення ординати Y на прирощення абсциси X. візьміть дві точки на прямій, відніміть відповідні координати однієї точки з координат іншої і поділіть різницю Y на різницю X.
ВизначтеНахил прямої, що проходить через експериментальні точки. щоб знайти кутовий коефіцієнт прямої, слід поділити прирощення ординати Y на прирощення абсциси X. візьміть дві точки на прямій, відніміть відповідні координати однієї точки з координат іншої і поділіть різницю Y на різницю X.- Нахил прямий (кутовий коефіцієнт, або тангенс кута нахилу) знаходиться наступним чином: (Y2 - Y1)/(X2 - X1). При цьому точці, розташованій вище по прямій, присвоєно індекс 2, а нижчій точці — індекс 1.
- Припустимо, при молярній концентрації 0,2 поглинальна здатність склала 0,27, а при концентрації 0,3 вона дорівнювала 0,41. Поглинальна здатність відкладається по осі Y, а концентрація - по осі X. використовуючи наведене вище рівняння, знаходимо кутовий коефіцієнт прямої лінії: (Y2 - Y1)/(X2 - X1) = (0,41-0,27)/(0,3-0,2) = 0,14/0,1 = 1,4.
 Щоб знайти молярний коефіцієнт поглинання, поділіть кутовий коефіцієнт прямої лінії на пройдений світлом шлях (глибину кювети).пройдений світлом шлях дорівнює глибині кювети, яка була використана в спектрофотометрі.
Щоб знайти молярний коефіцієнт поглинання, поділіть кутовий коефіцієнт прямої лінії на пройдений світлом шлях (глибину кювети).пройдений світлом шлях дорівнює глибині кювети, яка була використана в спектрофотометрі.- Для нашого прикладу отримуємо: якщо кутовий коефіцієнт дорівнює 1,4, а глибина кювети становить 0,5 сантиметра, то молярний коефіцієнт поглинання 1,4/0,5 = 2,8 л моль-1 см-1.
Джерела
- ↑ Http://www.chemguide.co.uk/analysis/uvvisible/beerlambert.html
- ↑ Http://www.chm.davidson.edu/vce/spectrophotometry/beerslaw.html
- ↑ Http://www.chemguide.co.uk/analysis/uvvisible/beerlambert.html
- ↑ Http://www.chemguide.co.uk/analysis/uvvisible/beerlambert.html
- ↑ Http://www.chm.davidson.edu/vce/spectrophotometry/beerslaw.html
- ↑ Http://www.chemguide.co.uk/analysis/uvvisible/beerlambert.html
- ↑ Http://teaching.shu.ac.uk/hwb/chemistry/tutorials/molspec/beers1.htm
- ↑ Http://www.bbc.co.uk/bitesize/standard/physics/telecommunications/communication_using_waves/revision/5/
- ↑ Http://teaching.shu.ac.uk/hwb/chemistry/tutorials/molspec/beers1.htm