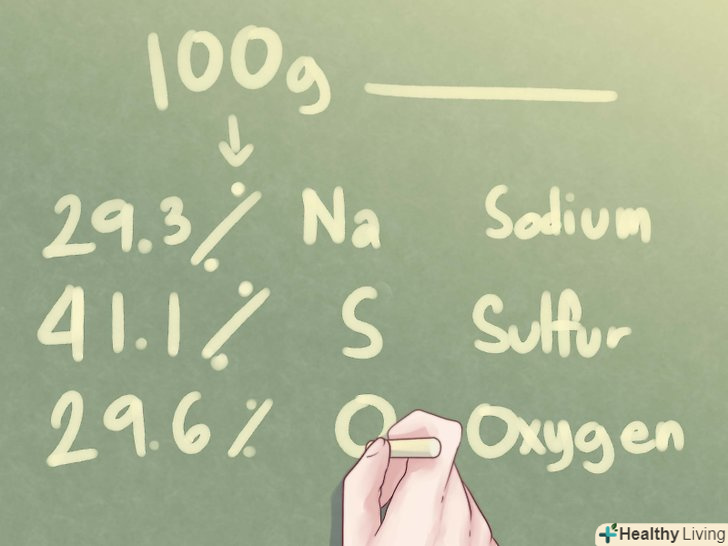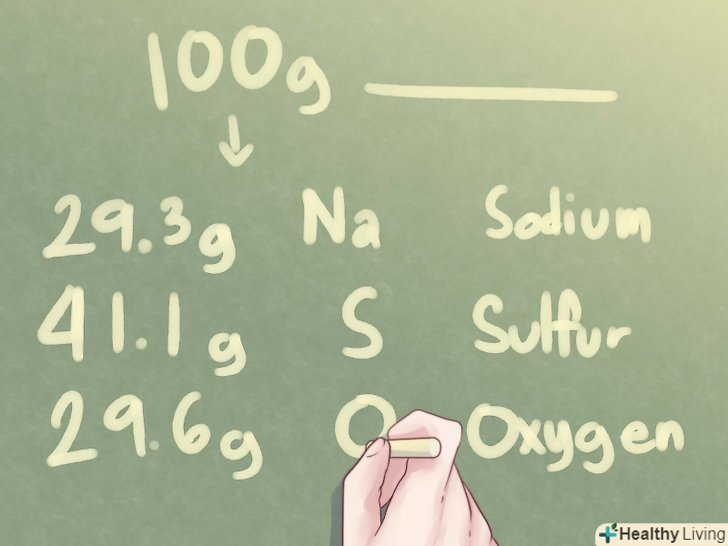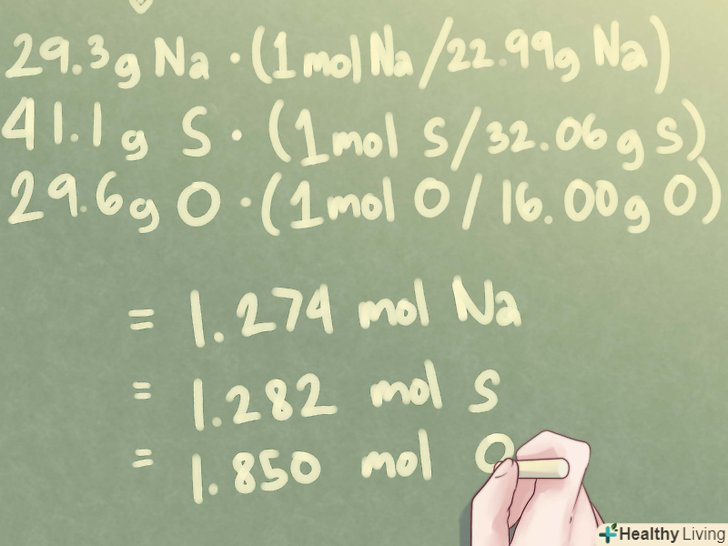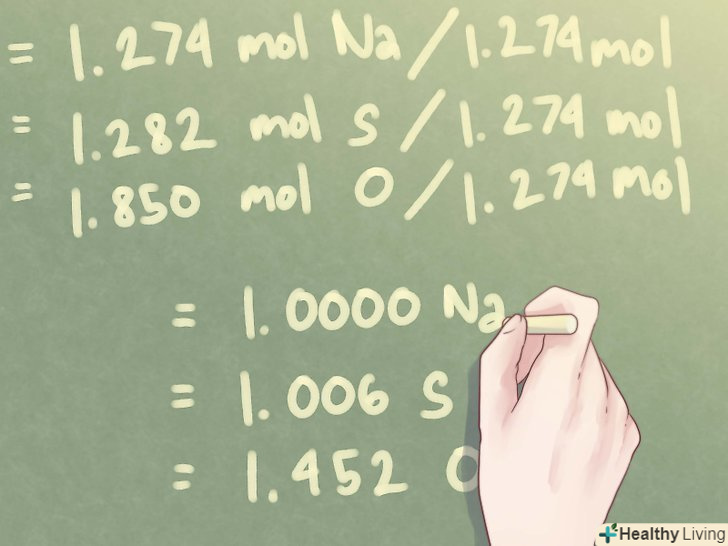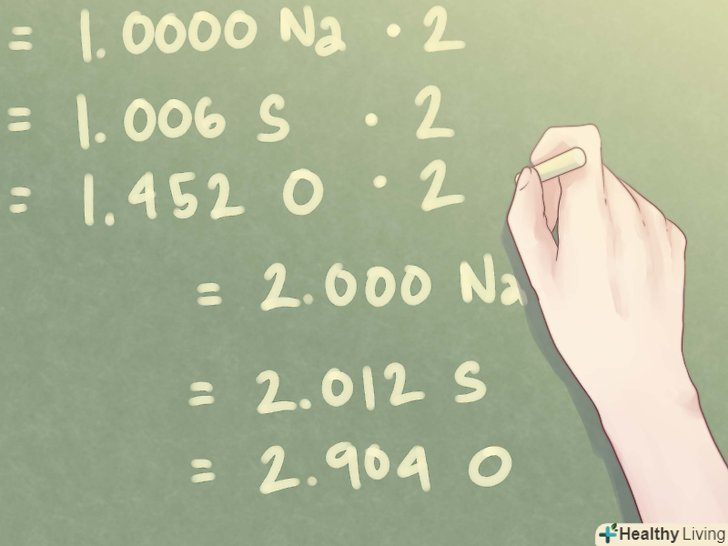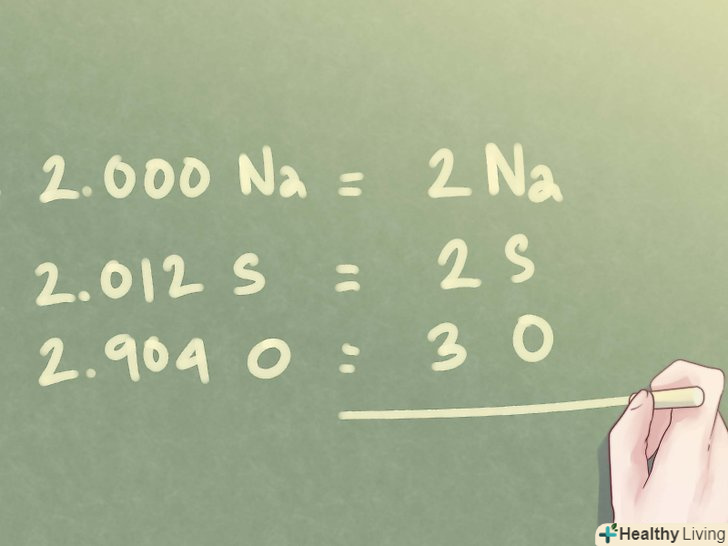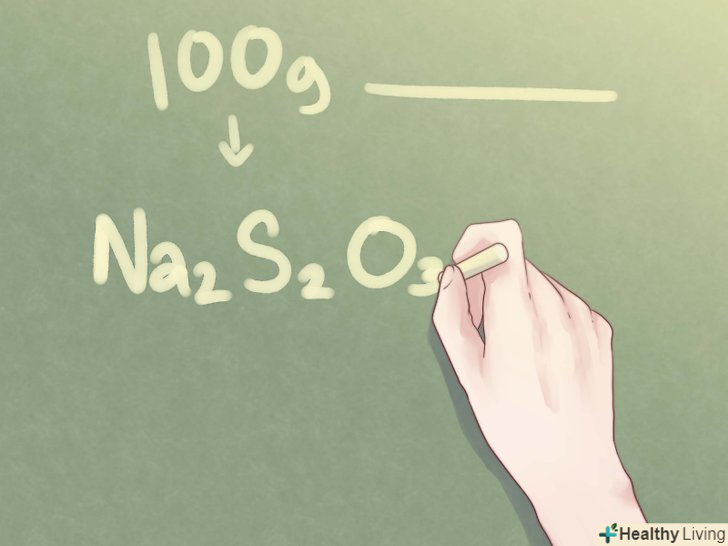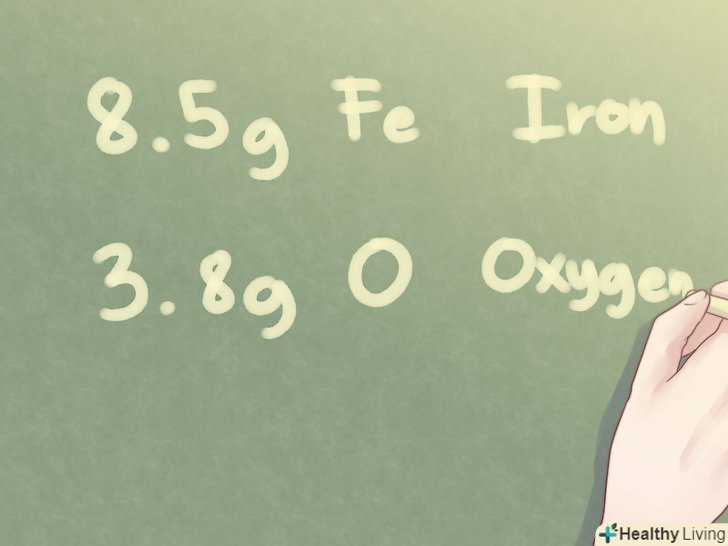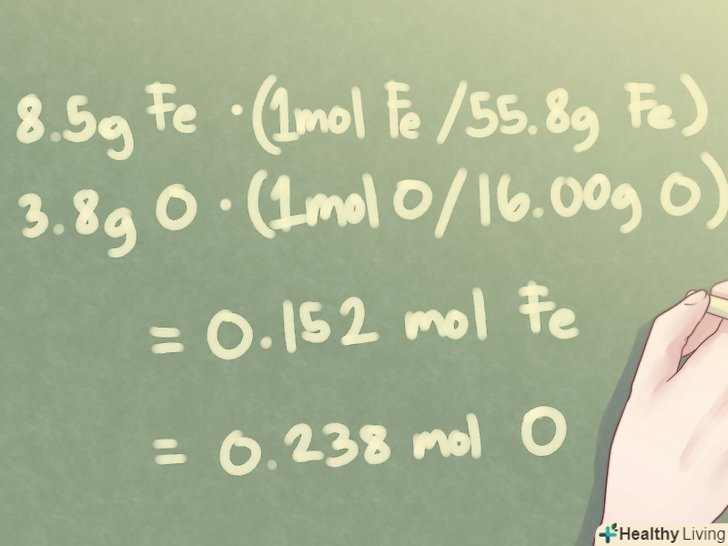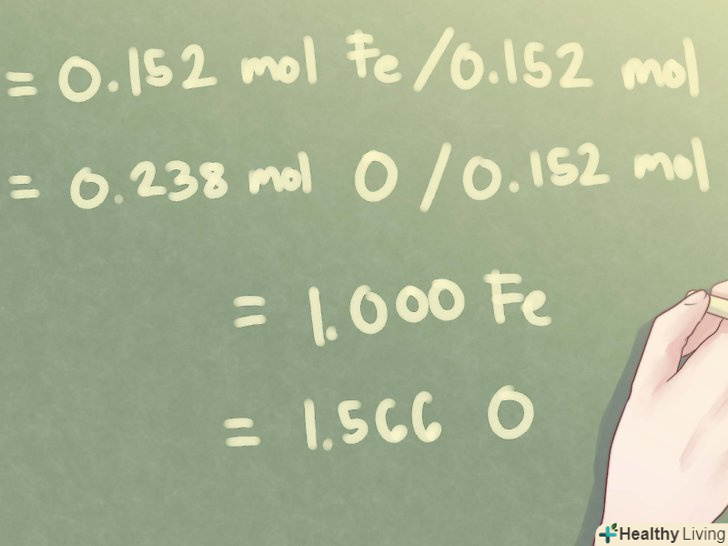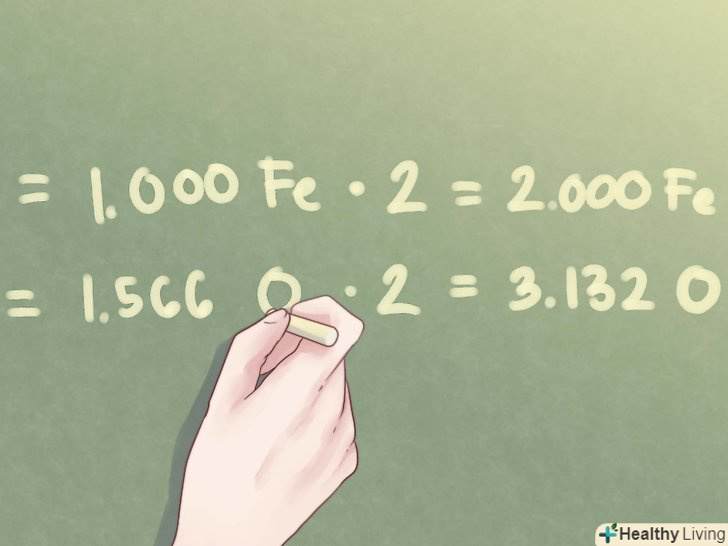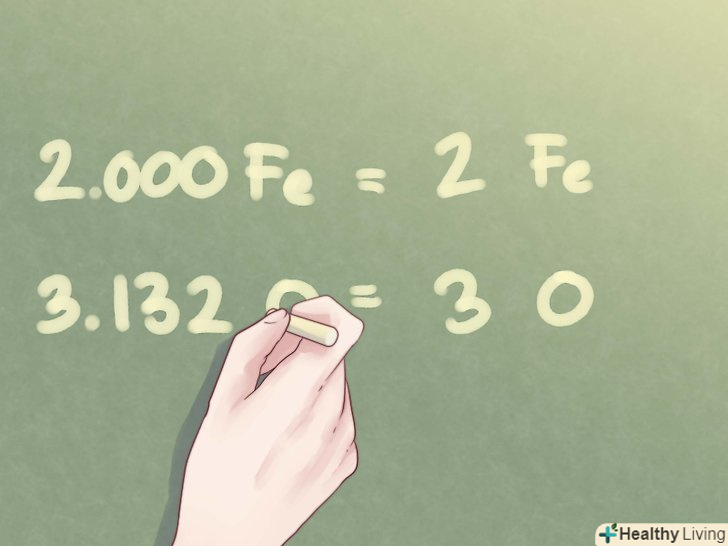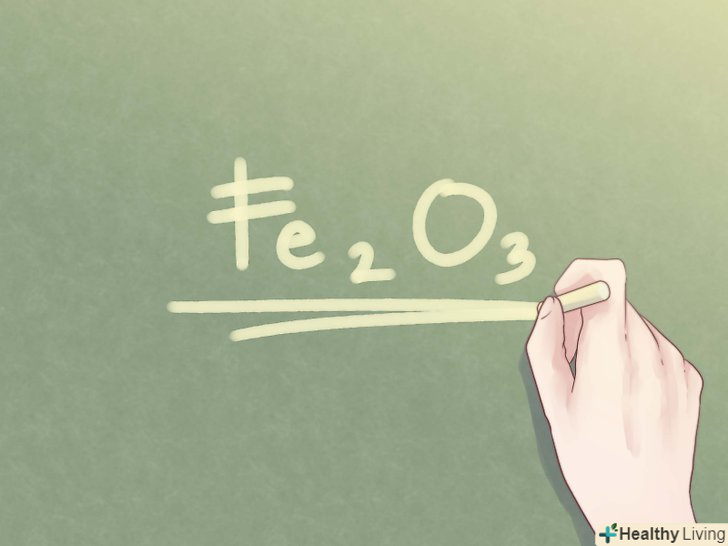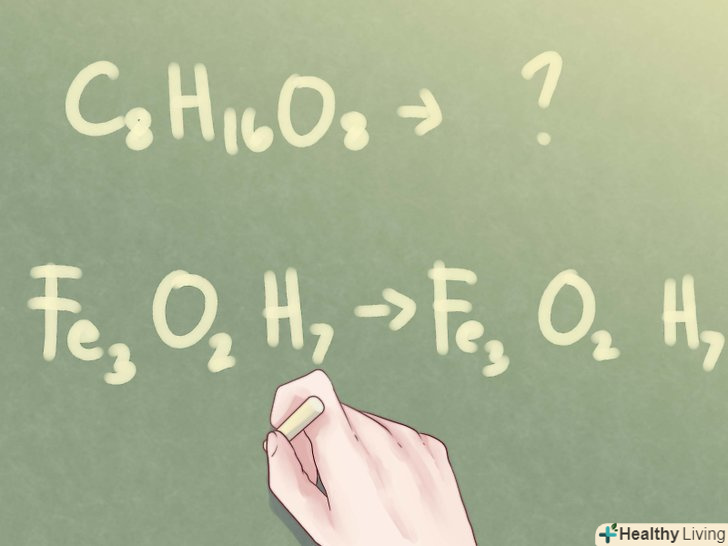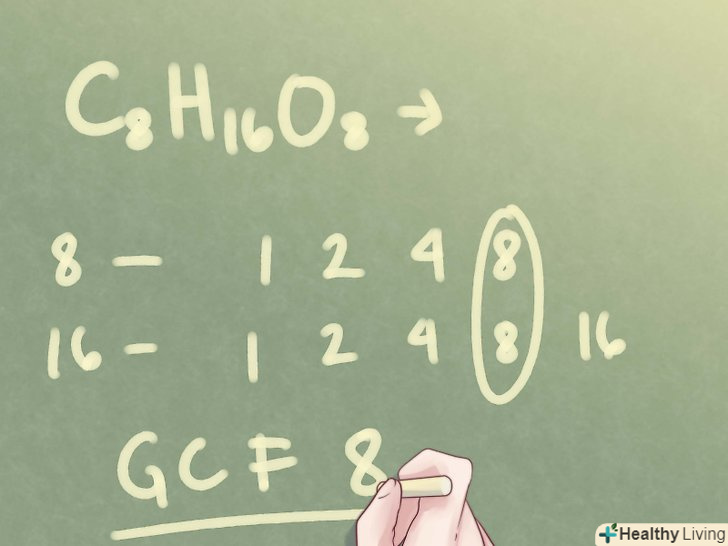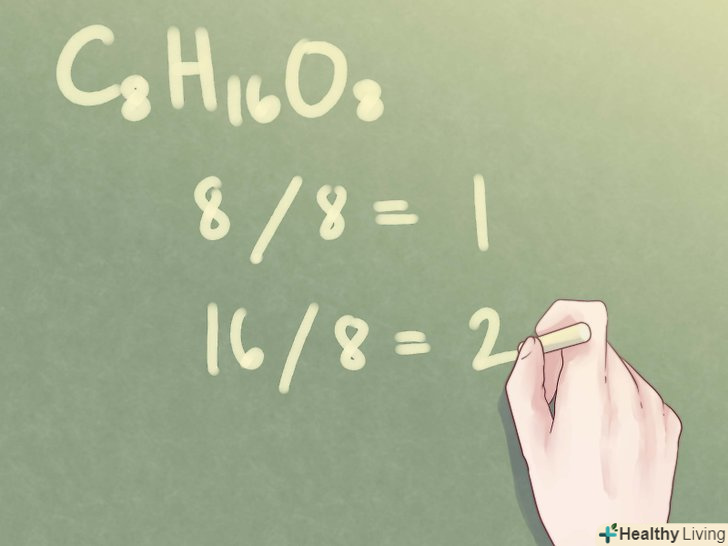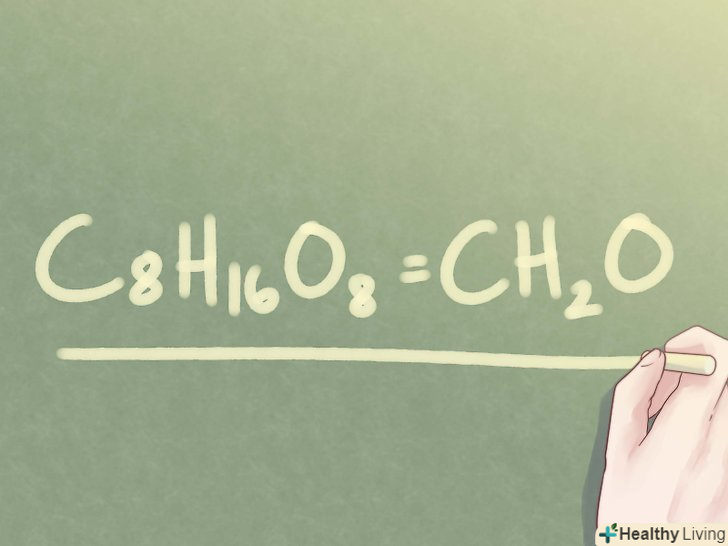Емпірична формула хімічної сполуки являє собою найпростішу запис його складу. Емпіричну формулу речовини можна визначити по масі кожного входить в нього елемента, по вагових відсотках елементів або по молекулярній формулі з'єднання.
Кроки
Метод1З 3:
З допомогою вагових відсотків[1]
Метод1З 3:
 Подивіться, що дано.якщо дано елементний склад невідомого з'єднання у відсотках, а не в грамах, слід припустити, що є рівно 100,0 грамів цієї речовини.
Подивіться, що дано.якщо дано елементний склад невідомого з'єднання у відсотках, а не в грамах, слід припустити, що є рівно 100,0 грамів цієї речовини.- Нижче наведена процедура визначення емпіричної формули в тому випадку, якщо елементний склад дано у відсотках. Якщо склад невідомого з'єднання даний в грамах, перейдіть до розділу "використання ваги в грамах".
- Приклад: визначте емпіричну формулу сполуки, яка складається з 29,3% Na (натрій), 41,1% S (сірка) і 29,6% O (кисень).
 Визначимо кількість грамів кожного елемента.якщо ми припустимо, що є 100 грамів невідомого з'єднання, то кількість грамів кожного елемента відповідає його процентному вмісту.
Визначимо кількість грамів кожного елемента.якщо ми припустимо, що є 100 грамів невідомого з'єднання, то кількість грамів кожного елемента відповідає його процентному вмісту.- Приклад: у 100 грамах невідомої речовини міститься 29,3 г Na, 41,1 г S і 29,6 г O.
 Переведіть масу кожного елемента в молі.масу кожного вхідного в з'єднання елемента слід перевести в молі. Для цього масу необхідно помножити на 1 моль і розділити на атомну вагу відповідного елемента.
Переведіть масу кожного елемента в молі.масу кожного вхідного в з'єднання елемента слід перевести в молі. Для цього масу необхідно помножити на 1 моль і розділити на атомну вагу відповідного елемента.- Простіше кажучи, слід розділити масу кожного елемента на його атомну вагу.
- Врахуйте також, що при даних розрахунках необхідно брати не менше чотирьох значущих цифр.
- Приклад: для з'єднання, яке складається з 29,3 г Na, 41,1 г S і 29,6 г O, отримуємо:
- 29,3 г Na *(1 моль Na / 22,99 г Na) = 1,274 моль na
- 41,1 г S * (1 моль S / 32,06 г S) = 1,282 моль s
- 29,6 г O *(1 моль O / 16,00 г O) = 1,850 моль o
 Розділіть знайдене число молей кожного елемента на найменшу кількість молей. слід знайти стехіометричне співвідношення між елементами-це означає, що необхідно обчислити відносні частки кожного елемента в порівнянні з іншими елементами, що входять до складу з'єднання. Для цього розділіть кожну кількість молей на найменше число молей.
Розділіть знайдене число молей кожного елемента на найменшу кількість молей. слід знайти стехіометричне співвідношення між елементами-це означає, що необхідно обчислити відносні частки кожного елемента в порівнянні з іншими елементами, що входять до складу з'єднання. Для цього розділіть кожну кількість молей на найменше число молей.- Приклад: найменше число молей в даному з'єднанні становить 1,274 моль (кількість молей Na, натрію).
- 1,274 моль Na / 1,274 моль = 1,000 Na
- 1,282 моль S / 1,274 моль = 1,006 s
- 1,850 моль O / 1,274 моль = 1,452 O
- Приклад: найменше число молей в даному з'єднанні становить 1,274 моль (кількість молей Na, натрію).
 Помножте отримані величини на коефіцієнт так, щоб вийшли близькі до цілих числа. співвідношення молей кожного елемента може не дорівнювати цілому числу. Це не проблема в разі малих відхилень від цілого числа, які не перевищують одну десяту. Однак у разі більш значних відхилень слід помножити ці величини на один і той же множник, щоб вони стали близькі до цілих чисел.
Помножте отримані величини на коефіцієнт так, щоб вийшли близькі до цілих числа. співвідношення молей кожного елемента може не дорівнювати цілому числу. Це не проблема в разі малих відхилень від цілого числа, які не перевищують одну десяту. Однак у разі більш значних відхилень слід помножити ці величини на один і той же множник, щоб вони стали близькі до цілих чисел.- Якщо відповідна величина для одного елемента близька до 0,5, помножте кожне значення на 2. Схожим чином, якщо для одного елемента число близько до 0,25, помножте кожну величину на 4.
- Приклад: оскільки кількість кисню (O) близько до 1,5, щоб наблизити його до цілого значення, необхідно помножити кожну величину на "2".
- 1,000 Na * 2 = 2,000 Na
- 1,006 S * 2 = 2,012 S
- 1,452 O * 2 = 2,904 O
 Округліть отримані величини до найближчих цілих чисел.навіть після останнього кроку кількість молей кожного елемента може злегка відрізнятися від цілого числа. Оскільки в емпіричних формулах не використовуються десяткові дроби, необхідно округлити кожне значення до найближчого до нього цілого числа.
Округліть отримані величини до найближчих цілих чисел.навіть після останнього кроку кількість молей кожного елемента може злегка відрізнятися від цілого числа. Оскільки в емпіричних формулах не використовуються десяткові дроби, необхідно округлити кожне значення до найближчого до нього цілого числа.- Приклад: для визначених на попередньому кроці значень отримуємо:
- 2,000 Na можна записати як 2 Na;
- 2,012 S можна округлити до 2 S;
- 2,904 O можна округлити до 3 O.
- Приклад: для визначених на попередньому кроці значень отримуємо:
 Запишіть остаточну відповідь.перекладіть співвідношення елементів у стандартний запис, який використовується для емпіричних формул. Кількість кожного елемента в молекулі з'єднання записується у вигляді підрядкового числа праворуч від символу відповідного елемента (в разі одиниці це число опускається).
Запишіть остаточну відповідь.перекладіть співвідношення елементів у стандартний запис, який використовується для емпіричних формул. Кількість кожного елемента в молекулі з'єднання записується у вигляді підрядкового числа праворуч від символу відповідного елемента (в разі одиниці це число опускається).- Приклад: якщо з'єднання складається з 2 частин Na, 2 частин S і 3 частин O, його емпірична формула записується наступним чином: Na2S2O3
Метод2 З 3:
За допомогою ваги в грамах
Метод2 З 3:
 Переконайтеся, що кількість елементів дано в грамах.якщо елементний склад невідомої сполуки дано в грамах, використовуйте наведені нижче кроки.
Переконайтеся, що кількість елементів дано в грамах.якщо елементний склад невідомої сполуки дано в грамах, використовуйте наведені нижче кроки.- З іншого боку, якщо замість грамів дані відсотки, перейдіть до розділу"використання вагових відсотків".
- Приклад: визначте емпіричну формулу невідомої сполуки, яка складається з 8,5 г Fe (залізо) і 3,8 г O (кисень).
 Переведіть масу кожного елемента в молі.щоб визначити частку кожного елемента в молекулі сполуки, необхідно перевести кількість кожного елемента з грамів в молі. Для цього розділіть масу кожного елемента в грамах на його атомну вагу.
Переведіть масу кожного елемента в молі.щоб визначити частку кожного елемента в молекулі сполуки, необхідно перевести кількість кожного елемента з грамів в молі. Для цього розділіть масу кожного елемента в грамах на його атомну вагу.- При більш формальному підході слід помножити масу в грамах на один моль і розділити на атомну вагу.
- Врахуйте, що для достатньої точності атомну вагу необхідно округлити до чотирьох значущих цифр.
- Приклад: для 8,5 г Fe і 3,8 г o отримуємо:
- 8,5 г Fe *(1 моль Fe / 55,85 г Fe) = 0,152 моль fe
- 3,8 г O * (1 моль O / 16,00 г O) = 0,238 моль o
 Розділіть кількість молей кожного елемента на найменше значення. визначте, як кожен елемент співвідноситься з іншими елементами, що входять в дане з'єднання. Для цього необхідно знайти мінімальну кількість молей і розділити на нього число молей кожного елемента.
Розділіть кількість молей кожного елемента на найменше значення. визначте, як кожен елемент співвідноситься з іншими елементами, що входять в дане з'єднання. Для цього необхідно знайти мінімальну кількість молей і розділити на нього число молей кожного елемента.- Для нашого випадку мінімальна кількість молей становить 0,152 (кількість Fe, заліза).
- 0,152 моль Fe / 0,152 моль = 1,000 Fe
- 0,238 моль O / 0,152 моль = 1,566 O
- Для нашого випадку мінімальна кількість молей становить 0,152 (кількість Fe, заліза).
 Помножте отримані значення, щоб знайти числа, близькі до цілих.Часто кількість молей не дорівнює цілому числу. Якщо відхилення від цілого числа не перевищує однієї десятої, таке число можна просто округлити до цілого. Однак в разі більш значного відхилення слід помножити кожне значення на такий коефіцієнт, щоб вийшли близькі до цілих числа.
Помножте отримані значення, щоб знайти числа, близькі до цілих.Часто кількість молей не дорівнює цілому числу. Якщо відхилення від цілого числа не перевищує однієї десятої, таке число можна просто округлити до цілого. Однак в разі більш значного відхилення слід помножити кожне значення на такий коефіцієнт, щоб вийшли близькі до цілих числа.- Наприклад, якщо кількість одного елемента перевищує ціле число приблизно на 0,25, помножте всі значення на 4. Якщо ж відхилення становить близько 0,5, помножте всі величини на 2.
- Приклад: оскільки співвідношення для кисню становить 1,566, необхідно помножити обидва співвідношення на 2.
- 1,000 Fe * 2 = 2,000 Fe
- 1,566 O * 2 = 3,132 O
 Округліть відповідь до найближчого цілого числа.після того як співвідношення для всіх елементів не будуть відрізнятися від цілих чисел більш ніж на одну десяту, округліть їх.
Округліть відповідь до найближчого цілого числа.після того як співвідношення для всіх елементів не будуть відрізнятися від цілих чисел більш ніж на одну десяту, округліть їх.- Приклад: кількість Fe можна записати як 2. Кількість O можна округлити до 3.
 Запишіть відповідь.знайдене співвідношення елементів слід переписати у формі, прийнятій для емпіричних формул. Отримані цілі числа (за винятком 1) необхідно записати у вигляді підрядкових символів праворуч від символу відповідного елемента.
Запишіть відповідь.знайдене співвідношення елементів слід переписати у формі, прийнятій для емпіричних формул. Отримані цілі числа (за винятком 1) необхідно записати у вигляді підрядкових символів праворуч від символу відповідного елемента.- Приклад: для з'єднання 2 частин Fe і 3 частин o емпірична формула має наступний вигляд: Fe2O3
Метод3 З 3:
З допомогою молекулярної формули[2]
Метод3 З 3:
 Визначте, чи можна скоротити підрядкові числа.якщо дана Молекулярна формула невідомої сполуки і потрібно визначити емпіричну формулу, перевірте, чи не можна скоротити кількість атомів. Подивіться на підрядкові числа біля кожного елемента. Якщо всі вони мають спільний дільник (відмінний від 1), знадобиться кілька кроків, щоб визначити емпіричну формулу з'єднання.
Визначте, чи можна скоротити підрядкові числа.якщо дана Молекулярна формула невідомої сполуки і потрібно визначити емпіричну формулу, перевірте, чи не можна скоротити кількість атомів. Подивіться на підрядкові числа біля кожного елемента. Якщо всі вони мають спільний дільник (відмінний від 1), знадобиться кілька кроків, щоб визначити емпіричну формулу з'єднання.- Приклад: C8H 16O8
- З іншого боку, якщо підрядкові числа не мають спільного дільника, Молекулярна формула є емпіричною формулою.
- приклад:Fe3O 2H7
 Знайдіть найбільший спільний дільник підрядкових чисел.випишіть дільники для кожного підрядкового числа і визначте максимальний загальний дільник.
Знайдіть найбільший спільний дільник підрядкових чисел.випишіть дільники для кожного підрядкового числа і визначте максимальний загальний дільник.- Приклад: з'єднання C8H16O8 має підрядкові числа "4" and "8".
- Число 8 має наступні дільники: 1, 2, 4, 8
- Число 16 має наступні дільники: 1, 2, 4, 8, 16
- Число 8 є найбільшим спільним дільником.
- Приклад: з'єднання C8H16O8 має підрядкові числа "4" and "8".
 Розділіть кожне підрядкове число на найбільший спільний дільник. щоб привести кожне підрядкове число до найпростішої форми, необхідно розділити його на тільки що знайдений найбільший спільний дільник.
Розділіть кожне підрядкове число на найбільший спільний дільник. щоб привести кожне підрядкове число до найпростішої форми, необхідно розділити його на тільки що знайдений найбільший спільний дільник.- Приклад: для C8H 16O8 отримуємо:
- Ділимо підрядкове число 8 на найбільший спільний дільник 8: 8 / 8 = 1
- Ділимо підрядкове число 16 на найбільший спільний дільник 8: 16 / 8 = 2
- Приклад: для C8H 16O8 отримуємо:
 Запишіть відповідь.Замініть початкові підрядкові числа їх спрощеними значеннями. Таким чином ви визначите емпіричну формулу сполуки за його молекулярною формулою.
Запишіть відповідь.Замініть початкові підрядкові числа їх спрощеними значеннями. Таким чином ви визначите емпіричну формулу сполуки за його молекулярною формулою.- Пам'ятайте, що якщо підрядкове число дорівнює 1, то його зазвичай не записують.
- Приклад: C8H 16O8 = CH2o