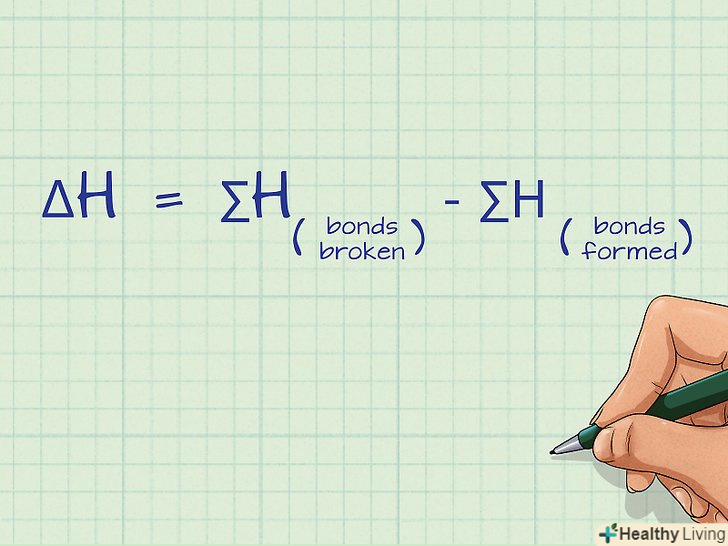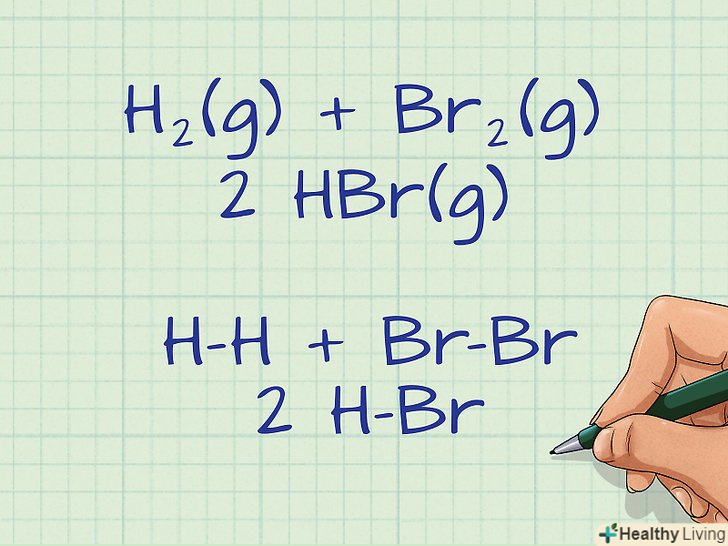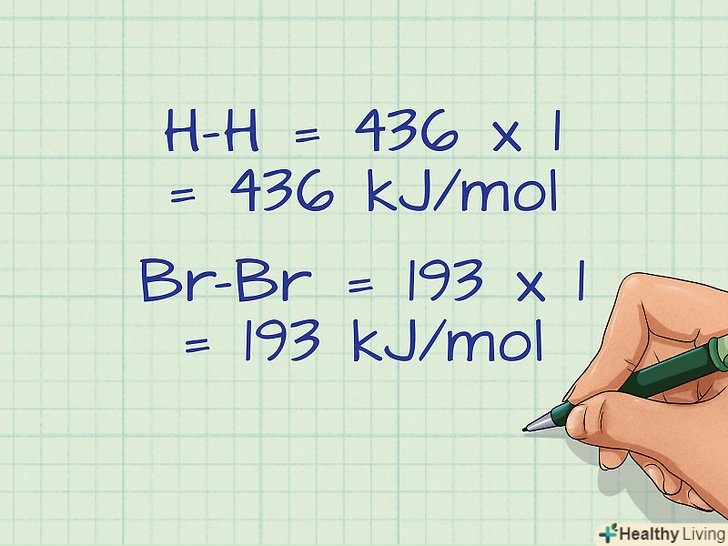Енергія зв'язку є важливим поняттям в хімії. Вона визначає кількість енергії, яка необхідна для розриву ковалентного зв'язку між двома атомами газу.[1] дане поняття не застосовується по відношенню до іонних зв'язків.[2] коли два атоми з'єднуються в молекулу, можна визначити, наскільки міцний зв'язок між ними-досить знайти енергію, яку необхідно затратити для розриву цього зв'язку. Пам'ятайте, що одиничний атом не володіє енергією зв'язку, ця енергія характеризує силу зв'язку двох атомів в молекулі. Щоб розрахувати енергію зв'язку для будь-якої хімічної реакції, просто визначте загальну кількість розірваних зв'язків і відніміть з нього кількість утворилися зв'язків.
Кроки
Частина1 З 2:
Визначте розірвані та утворені зв'язки
Частина1 З 2:
 Запишіть рівняння для обчислення енергії зв'язку. згідно з визначенням, енергія зв'язку являє собою суму розірваних зв'язків за вирахуванням суми сформованих зв'язків:ΔH = ∑H(розірвані зв'язки) - ∑H(утворилися зв'язку). ΔH позначає зміну енергії зв'язку, яке називають також ентальпією зв'язку, а δH відповідає сумі енергій зв'язку для обох частин рівняння хімічної реакції.[3]
Запишіть рівняння для обчислення енергії зв'язку. згідно з визначенням, енергія зв'язку являє собою суму розірваних зв'язків за вирахуванням суми сформованих зв'язків:ΔH = ∑H(розірвані зв'язки) - ∑H(утворилися зв'язку). ΔH позначає зміну енергії зв'язку, яке називають також ентальпією зв'язку, а δH відповідає сумі енергій зв'язку для обох частин рівняння хімічної реакції.[3]- Ця рівність виражає закон Гесса.
- Енергія зв'язку вимірюється в кілоджоулях на моль (кДж/моль).[4]
 Запишіть хімічне рівняння і позначте всі зв'язки між окремими елементами.якщо дано рівняння реакції у вигляді хімічних символів і цифр, корисно переписати його і позначити всі зв'язки між атомами. Така наочна запис дозволить вам легко порахувати зв'язку, які розриваються і утворюються в ході даної реакції.
Запишіть хімічне рівняння і позначте всі зв'язки між окремими елементами.якщо дано рівняння реакції у вигляді хімічних символів і цифр, корисно переписати його і позначити всі зв'язки між атомами. Така наочна запис дозволить вам легко порахувати зв'язку, які розриваються і утворюються в ході даної реакції.- Пам'ятайте, що в лівій частині рівняння розташовані реагенти, а в правій — продукти реакції.
- Одинарні, подвійні і потрійні зв'язки володіють різною енергією, тому будьте уважні і правильно позначайте зв'язку між різними елементами.[5]
- Наприклад, розглянемо наступну реакцію: H2(газ) + Br2(газ) ---&#gt; 2 HBr (газ)
- H-H + Br-Br ---&#gt; 2 H-Br
 Вивчіть правила підрахунку розірваних і утворилися зв'язків.у більшості випадків при розрахунках використовуються середні значення енергії зв'язку.[6] одна і та ж зв'язок може мати трохи різну енергію, в залежності від конкретної молекули, тому зазвичай використовують середні значення енергії зв'язку.[7].
Вивчіть правила підрахунку розірваних і утворилися зв'язків.у більшості випадків при розрахунках використовуються середні значення енергії зв'язку.[6] одна і та ж зв'язок може мати трохи різну енергію, в залежності від конкретної молекули, тому зазвичай використовують середні значення енергії зв'язку.[7].- Розриви одинарної, подвійний і потрійний хімічного зв'язку розглядаються як одна розірвана зв'язок. Хоча ці зв'язки мають різні енергії, в кожному випадку вважається, що розривається один зв'язок.
- Те ж саме відноситься і до утворення одинарної, подвійний або потрійний зв'язку. Кожен такий випадок розглядається як формування одного нового зв'язку.
- У нашому прикладі всі зв'язки є одинарними.
 Визначте, які зв'язки розриваються в лівій частині рівняння.ліва частина хімічного рівняння містить реагуючі речовини, і в ній представлені всі зв'язки, які розриваються в результаті реакції. Це ендотермічний процес, тобто для розриву хімічних зв'язків необхідно затратити певну енергію.[8]
Визначте, які зв'язки розриваються в лівій частині рівняння.ліва частина хімічного рівняння містить реагуючі речовини, і в ній представлені всі зв'язки, які розриваються в результаті реакції. Це ендотермічний процес, тобто для розриву хімічних зв'язків необхідно затратити певну енергію.[8]- На нашому прикладі ліва частина рівняння реакції містить одну зв'язок H-H і одну зв'язок Br-Br.
 Підрахуйте кількість утворилися зв'язків в правій частині рівняння. Справа вказані продукти реакції. У цій частині рівняння представлені всі зв'язки, які утворюються в результаті хімічної реакції. Це екзотермічний процес, і він протікає з виділенням енергії (зазвичай у вигляді тепла).[9]
Підрахуйте кількість утворилися зв'язків в правій частині рівняння. Справа вказані продукти реакції. У цій частині рівняння представлені всі зв'язки, які утворюються в результаті хімічної реакції. Це екзотермічний процес, і він протікає з виділенням енергії (зазвичай у вигляді тепла).[9]- У нашому прикладі в правій частині рівняння містяться два зв'язки H-Br.
Частина2 З 2:
Розрахуйте енергію зв'язку
Частина2 З 2:
 Знайдіть необхідні значення енергії зв'язку.є безліч таблиць, в яких наведені значення енергії зв'язку для самих різних з'єднань. Такі таблиці можна знайти в інтернеті або довіднику з хімії. Слід пам'ятати, що значення енергії зв'язку завжди наводяться для молекул в газоподібному стані.[10]
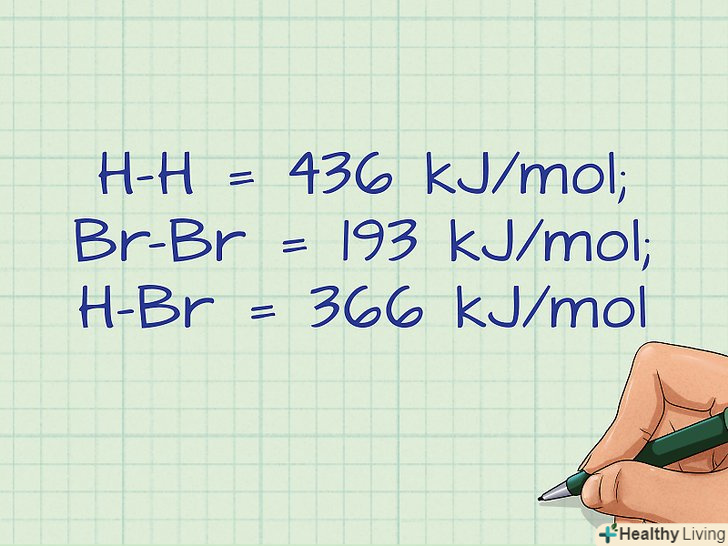
Знайдіть необхідні значення енергії зв'язку.є безліч таблиць, в яких наведені значення енергії зв'язку для самих різних з'єднань. Такі таблиці можна знайти в інтернеті або довіднику з хімії. Слід пам'ятати, що значення енергії зв'язку завжди наводяться для молекул в газоподібному стані.[10]- Для нашого прикладу необхідно знайти значення енергії зв'язків H-H, Br-Br і H-Br.
- H-H = 436 кДж/моль; Br-Br = 193 кДж/моль; H-Br = 366 кДж/моль.[11]
- Щоб обчислити енергію зв'язку для молекул в рідкому стані, необхідно також знайти ентальпію випаровування даної рідини. Це кількість енергії, яка необхідна для перекладу речовини з рідкого в газоподібний стан.[12] дане значення додається до загальної енергії зв'язку.
- Наприклад, у випадку води необхідно додати в рівняння ентальпію випаровування води (+41 кДж).[13]
 Помножте значення енергії зв'язку на число розірваних зв'язків.у ряді реакцій один зв'язок може розриватися кілька разів.[14] наприклад, якщо молекула складається з 4 атомів водню, то енергію зв'язку водню слід врахувати 4 рази, тобто помножити на 4.
Помножте значення енергії зв'язку на число розірваних зв'язків.у ряді реакцій один зв'язок може розриватися кілька разів.[14] наприклад, якщо молекула складається з 4 атомів водню, то енергію зв'язку водню слід врахувати 4 рази, тобто помножити на 4.- У нашому прикладі кожна молекула має по одній зв'язку, тому значення енергії зв'язку просто множаться на 1.
- H-H = 436 x 1 = 436 кДж/моль
- Br-Br = 193 x 1 = 193 кДж/моль
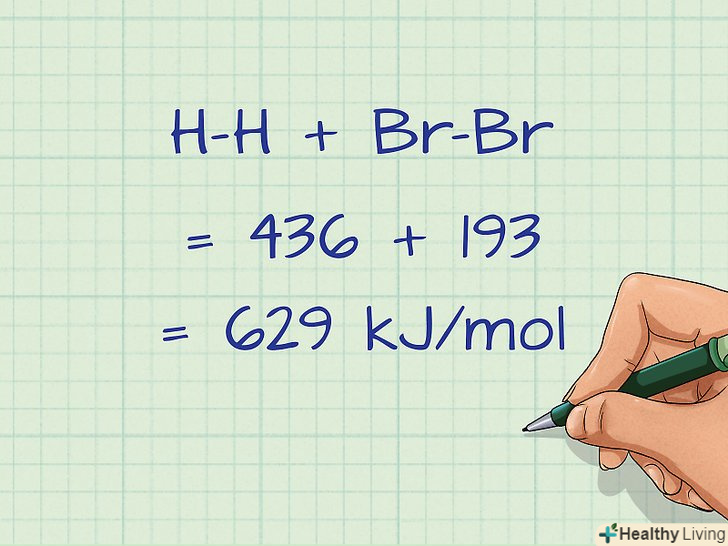
 Складіть всі енергії розірваних зв'язків.після того як ви помножите значення енергій зв'язку на відповідну кількість зв'язків в лівій частині рівняння, необхідно знайти загальну суму.[15]
Складіть всі енергії розірваних зв'язків.після того як ви помножите значення енергій зв'язку на відповідну кількість зв'язків в лівій частині рівняння, необхідно знайти загальну суму.[15]- Знайдемо сумарну енергію розірваних зв'язків для нашого прикладу: H-H + Br-Br = 436 + 193 = 629 кДж/моль.
 Помножте значення енергії зв'язку на кількість утворилися зв'язків.як і у випадку з розірваними зв'язками в лівій частині рівняння, слід взяти значення енергій зв'язку в правій частині рівняння і помножити їх на відповідне число цих зв'язків.[16] наприклад, якщо утворюється чотири зв'язки між атомами водню, необхідно помножити енергію даного зв'язку на 4.
Помножте значення енергії зв'язку на кількість утворилися зв'язків.як і у випадку з розірваними зв'язками в лівій частині рівняння, слід взяти значення енергій зв'язку в правій частині рівняння і помножити їх на відповідне число цих зв'язків.[16] наприклад, якщо утворюється чотири зв'язки між атомами водню, необхідно помножити енергію даного зв'язку на 4.- У нашому прикладі утворюється два зв'язки H-Br, тому енергію зв'язку H-Br (366 кДж/моль) слід помножити на 2: 366 x 2 = 732 кДж/моль.
 Складіть всі енергії утворилися зв'язків.як і у випадку розірваних зв'язків, слід скласти всі енергії утворилися зв'язків, які представлені в правій частині рівняння.[17] якщо в результаті реакції утворюється лише одна речовина, даний крок можна пропустити.
Складіть всі енергії утворилися зв'язків.як і у випадку розірваних зв'язків, слід скласти всі енергії утворилися зв'язків, які представлені в правій частині рівняння.[17] якщо в результаті реакції утворюється лише одна речовина, даний крок можна пропустити.- У нашому прикладі утворюється одна речовина, тому енергія сформованих зв'язків дорівнює подвоєній енергії зв'язку H-Br, тобто 732 кДж/моль.
 Відніміть енергію утворилися зв'язків з енергії розірваних зв'язків. після того як ви складіть всі зв'язки в лівій і правій частинах рівняння, просто відніміть від розірваних зв'язків утворилися зв'язку. Згадайте наведене вище рівняння: ΔH = ∑H(розірвані зв'язки) - ∑H(утворилися зв'язку). Підставте обчислені значення і знайдіть різницю.
Відніміть енергію утворилися зв'язків з енергії розірваних зв'язків. після того як ви складіть всі зв'язки в лівій і правій частинах рівняння, просто відніміть від розірваних зв'язків утворилися зв'язку. Згадайте наведене вище рівняння: ΔH = ∑H(розірвані зв'язки) - ∑H(утворилися зв'язку). Підставте обчислені значення і знайдіть різницю.- Для нашого прикладу маємо: ΔH = ∑H(розірвані зв'язки) - ∑H(утворені зв'язки) = 629 кДж/моль - 732 кДж/моль = -103 кДж/моль.
 Визначте, чи є реакція ендотермічною або екзотермічною.останній крок при обчисленні енергії зв'язку полягає в тому, щоб з'ясувати, поглинається або виділяється енергія в ході даної реакції. При ендотермічних реакціях енергія поглинається, і підсумкова енергія зв'язку має позитивне значення, в той час як при екзотермічних реакціях енергія виділяється, і енергія зв'язку приймає негативні значення.[18]
Визначте, чи є реакція ендотермічною або екзотермічною.останній крок при обчисленні енергії зв'язку полягає в тому, щоб з'ясувати, поглинається або виділяється енергія в ході даної реакції. При ендотермічних реакціях енергія поглинається, і підсумкова енергія зв'язку має позитивне значення, в той час як при екзотермічних реакціях енергія виділяється, і енергія зв'язку приймає негативні значення.[18]- У нашому прикладі загальна енергія зв'язку негативна, тобто розглянута реакція є екзотермічною.
Джерела
- ↑ http://chemwiki.ucdavis.edu/Core/Theoretical_Chemistry/Chemical_Bonding/General_Principles_of_Chemical_Bonding/Bond_Energies
- ↑ Http://www.science.uwaterloo.ca/~cchieh/cact/c120/bondel.html
- ↑ Http://www.kentchemistry.com/links/Kinetics/BondEnergy.htm
- ↑ Http://chemwiki.ucdavis.edu/Core/Theoretical_Chemistry/Chemical_Bonding/General_Principles_of_Chemical_Bonding/Bond_Energies
- ↑ Http://chemwiki.ucdavis.edu/Core/Theoretical_Chemistry/Chemical_Bonding/General_Principles_of_Chemical_Bonding/Bond_Energies
- ↑ Http://www.chemguide.co.uk/physical/energetics/bondenthalpies.html
- ↑ Http://chemwiki.ucdavis.edu/Core/Theoretical_Chemistry/Chemical_Bonding/General_Principles_of_Chemical_Bonding/Bond_Energies
- ↑ Http://www.chemteam.info/Thermochem/HessLawIntro3.html
- ↑ Http://www.chemteam.info/Thermochem/HessLawIntro3.html
- ↑ http://www.chemguide.co.uk/physical/energetics/bondenthalpies.html
- ↑ Http://www.science.uwaterloo.ca/~cchieh/cact/c120/bondel.html
- ↑ Http://www.chemguide.co.uk/physical/energetics/bondenthalpies.html
- ↑ Http://www.chemguide.co.uk/physical/energetics/bondenthalpies.html
- ↑ Http://www.chemteam.info/Thermochem/HessLawIntro3.html
- ↑ Http://www.chemteam.info/Thermochem/HessLawIntro3.html
- ↑ Http://www.chemteam.info/Thermochem/HessLawIntro3.html
- ↑ Http://www.chemteam.info/Thermochem/HessLawIntro3.html
- ↑ Http://chemwiki.ucdavis.edu/Core/Physical_Chemistry/Equilibria/Le_Chatelier's_Principle/Effect_Of_Temperature_On_Equilibrium_Composition/Exothermic_Versus_Endothermic_And_K