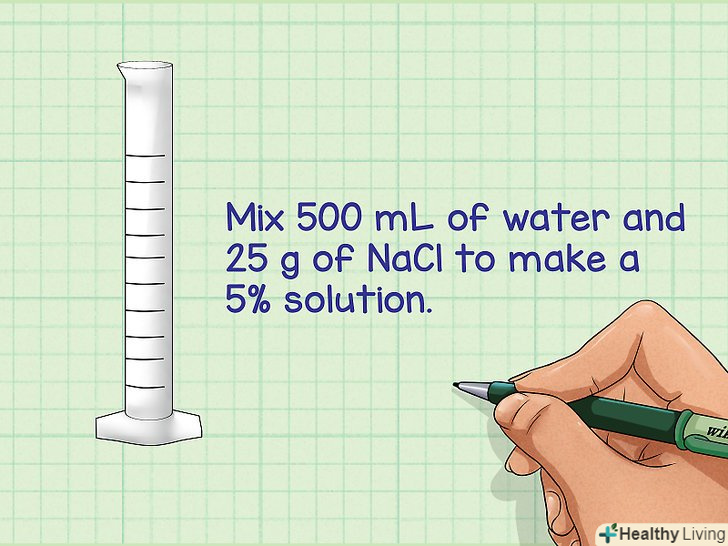Простіхімічні розчини можна легко приготувати різними способами в домашніх умовах або на роботі. Незалежно від того, чи отримуєте ви розчин з порошкового матеріалу або розбавляєте рідину, можна легко визначити правильну кількість кожного компонента. При приготуванні хімічних розчинів не забувайте використовувати персональні Засоби захисту, щоб уникнути пошкоджень.
Кроки
Метод1З 4:
Розрахунок відсотків за формулою для ваги / об'єму
Метод1З 4:
 ВизначтеПроцентне зміст по Вазі/об'єму розчину. відсотки показують, скільки частин речовини припадає на сто частин розчину. У застосуванні до хімічних розчинів це означає, що якщо концентрація становить 1 відсоток, значить, в 100 мілілітрах розчину міститься 1 грам речовини, тобто 1 мл/100 мл.[1]
ВизначтеПроцентне зміст по Вазі/об'єму розчину. відсотки показують, скільки частин речовини припадає на сто частин розчину. У застосуванні до хімічних розчинів це означає, що якщо концентрація становить 1 відсоток, значить, в 100 мілілітрах розчину міститься 1 грам речовини, тобто 1 мл/100 мл.[1]- Наприклад, за вагою: 10-відсотковий розчин за вагою містить 10 грамів речовини, розчинені в 100 мілілітрах розчину.
- Наприклад, за обсягом: 23-відсотковий розчин за обсягом містить 23 мілілітри рідкого з'єднання в кожних 100 мілілітрах розчину.
 Визначте обсяг розчину, який ви хочете приготувати.щоб з'ясувати необхідну масу речовини, спочатку слід визначити кінцевий обсяг необхідного вам розчину. Цей обсяг залежить від того, яка кількість розчину вам знадобиться, як часто ви його будете використовувати, і від стабільності готового розчину.
Визначте обсяг розчину, який ви хочете приготувати.щоб з'ясувати необхідну масу речовини, спочатку слід визначити кінцевий обсяг необхідного вам розчину. Цей обсяг залежить від того, яка кількість розчину вам знадобиться, як часто ви його будете використовувати, і від стабільності готового розчину.- Якщо кожен раз необхідно використовувати свіжий розчин, приготуйте лише таку кількість, яке необхідно для одного разу.
- Якщо розчин зберігає свої властивості протягом тривалого часу, можна приготувати більшу кількість, Щоб використовувати його в подальшому.
- Приклад: необхідно приготувати 5-відсотковий розчин NaCl об'ємом 500 мілілітрів.
 Розрахуйте кількість грамів речовини, яка потрібна для приготування розчину. щоб обчислити необхідну кількість грамів, використовуйте наступну формулу: число грамів = (необхідні відсотки) (необхідний обсяг/100 мл). При цьому необхідні відсотки виражаються в грамах, а необхідний обсяг — в мілілітрах.[2]
Розрахуйте кількість грамів речовини, яка потрібна для приготування розчину. щоб обчислити необхідну кількість грамів, використовуйте наступну формулу: число грамів = (необхідні відсотки) (необхідний обсяг/100 мл). При цьому необхідні відсотки виражаються в грамах, а необхідний обсяг — в мілілітрах.[2]- Приклад: необхідно приготувати 5-відсотковий розчин NaCl об'ємом 500 мілілітрів.
- Число грамів = (5г) (500мл/100мл) = 25 грамів.
- Якщо NaCl дано у вигляді розчину, просто візьміть 25 мілілітрів NaCl замість кількості грамів порошку і відніміть цей обсяг з кінцевого обсягу: 25 мілілітрів NaCl на 475 мілілітрів води.
 Зважте речовину.після того як ви порахуєте необхідну масу речовини, слід відміряти цю кількість. Візьміть відкалібровані ваги, помістіть на них чашу і виставте нуль. Зважте необхідну кількість речовини в грамах і відсипте його.
Зважте речовину.після того як ви порахуєте необхідну масу речовини, слід відміряти цю кількість. Візьміть відкалібровані ваги, помістіть на них чашу і виставте нуль. Зважте необхідну кількість речовини в грамах і відсипте його.- Перш ніж продовжувати готувати розчин, обов'язково очистіть чашу ваг від залишків порошку.
- У наведеному вище прикладі необхідно зважити 25 грамів NaCl.
 Розчиніть речовину в необхідній кількості рідини.якщо не вказано іншого, то в якості розчинника використовується вода. Візьміть мірну мензурку і відміряйте необхідну кількість рідини. Після цього розчиніть в рідині порошковий матеріал.[3]
Розчиніть речовину в необхідній кількості рідини.якщо не вказано іншого, то в якості розчинника використовується вода. Візьміть мірну мензурку і відміряйте необхідну кількість рідини. Після цього розчиніть в рідині порошковий матеріал.[3]- Підпишіть ємність, в якій ви будете зберігати розчин. Чітко вкажіть на ній речовина і його концентрацію.
- Приклад: розчиніть в 500 мілілітрах води 25 грамів NaCl, щоб отримати 5-відсотковий розчин.
- Пам'ятайте, що якщо ви розбавляєте рідку речовину, для отримання необхідної кількості води слід відняти обсяг додається речовини з кінцевого обсягу розчину: 500 мл – 25 мл = 475 мл води.
Метод2З 4:
Приготування молекулярного розчину
Метод2З 4:
 Визначте молекулярну вагу використовуваної речовини за формулою.Молекулярна вага за формулою (або просто молекулярна вага) сполуки записується в грамах на моль (г / моль) на стінці пляшки. Якщо ви не можете знайти на пляшці молекулярну вагу, пошукайте його в Інтернеті.[4]
Визначте молекулярну вагу використовуваної речовини за формулою.Молекулярна вага за формулою (або просто молекулярна вага) сполуки записується в грамах на моль (г / моль) на стінці пляшки. Якщо ви не можете знайти на пляшці молекулярну вагу, пошукайте його в Інтернеті.[4]- Молекулярна вага речовини являє собою масу (в грамах) одного моля цієї речовини.
- Приклад: молекулярна вага хлориду натрію (NaCl) становить 58,44 г/моль.
 Визначте обсяг необхідного розчину в літрах.дуже просто приготувати один літр розчину, так як його молярність виражається в молях/літр, проте може знадобитися зробити більше або менше літра, в залежності від призначення розчину. Використовуйте кінцевий обсяг, щоб розрахувати необхідну кількість грамів.[5]
Визначте обсяг необхідного розчину в літрах.дуже просто приготувати один літр розчину, так як його молярність виражається в молях/літр, проте може знадобитися зробити більше або менше літра, в залежності від призначення розчину. Використовуйте кінцевий обсяг, щоб розрахувати необхідну кількість грамів.[5]- Приклад: необхідно приготувати 50 мілілітрів розчину з мольною часткою NaCl 0,75.
- Щоб перевести мілілітри в літри, поділимо їх на 1000 і отримаємо 0,05 літра.
 Розрахуйте число грамів, необхідне для приготування необхідного молекулярного розчину.для цього слід використовувати наступну формулу: число грамів = (необхідний обсяг)(необхідна молярність)(молекулярна вага за формулою). Пам'ятайте, що необхідний обсяг виражається в літрах, молярність — в молях на літр, а молекулярна вага за формулою — в грамах на моль.[6]
Розрахуйте число грамів, необхідне для приготування необхідного молекулярного розчину.для цього слід використовувати наступну формулу: число грамів = (необхідний обсяг)(необхідна молярність)(молекулярна вага за формулою). Пам'ятайте, що необхідний обсяг виражається в літрах, молярність — в молях на літр, а молекулярна вага за формулою — в грамах на моль.[6]- Приклад: якщо ви хочете приготувати 50 мілілітрів розчину з мольною часткою NaCl 0,75 (молекулярна вага за формулою: 58,44 г/моль), слід розрахувати кількість грамів NaCl.
- Число грамів = 0,05 л * 0,75 моль/л * 58,44 г/моль = 2,19 грама NaCl.
- Скоротивши одиниці виміру, Ви отримаєте грами речовини.
 Зважте речовину.за допомогою правильно відкаліброваних ваг зважте необхідну кількість речовини. Розмістіть на вагах чашу і виставте нуль перед зважуванням. Додавайте в чашу речовина до тих пір, поки не отримаєте необхідну масу.
Зважте речовину.за допомогою правильно відкаліброваних ваг зважте необхідну кількість речовини. Розмістіть на вагах чашу і виставте нуль перед зважуванням. Додавайте в чашу речовина до тих пір, поки не отримаєте необхідну масу.- Після використання очистіть чашу ваг.
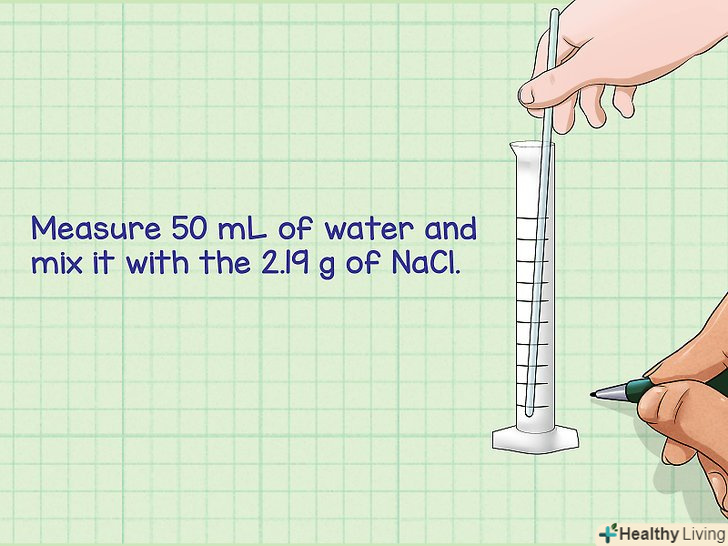
- Приклад: зважте 2,19 грама NaCl.
 Розчиніть порошок в необхідній кількості рідини.якщо не вказано іншого, для приготування більшості розчинів використовується вода. При цьому береться такий же обсяг рідини, який використовувався при розрахунку маси речовини. Додайте речовину в воду і перемішайте її до повного розчинення.
Розчиніть порошок в необхідній кількості рідини.якщо не вказано іншого, для приготування більшості розчинів використовується вода. При цьому береться такий же обсяг рідини, який використовувався при розрахунку маси речовини. Додайте речовину в воду і перемішайте її до повного розчинення.- Підпишіть ємність з розчином. Чітко позначте розчинену речовину і молярність, щоб можна було використовувати розчин в подальшому.
- Приклад: за допомогою мензурки (інструмент для вимірювання об'єму) відміряйте 50 мілілітрів води і розчиніть в ній 2,19 грама NaCl.
- Перемішуйте розчин до тих пір, поки порошок не розчиниться повністю.
Метод3З 4:
Розбавлення розчинів з відомою концентрацією
Метод3З 4:
 Визначте концентрацію кожного розчину.при розведенні розчинів необхідно знати концентрацію вихідного розчину і того розчину, який ви хочете отримати. Даний метод підходить для розведення концентрованих розчинів.[7]
Визначте концентрацію кожного розчину.при розведенні розчинів необхідно знати концентрацію вихідного розчину і того розчину, який ви хочете отримати. Даний метод підходить для розведення концентрованих розчинів.[7]- Приклад: необхідно приготувати 75 мілілітрів розчину NaCl концентрації 1,5 M з розчину концентрації 5 M. вихідний розчин має концентрацію 5 M, і необхідно розбавити його до концентрації 1,5 M.
 Визначте обсяг кінцевого розчину.необхідно знайти обсяг того розчину, який ви хочете отримати. Вам доведеться розрахувати кількість розчину, який буде потрібно, щоб розбавити даний розчин до отримання необхідних концентрації та обсягу.[8]
Визначте обсяг кінцевого розчину.необхідно знайти обсяг того розчину, який ви хочете отримати. Вам доведеться розрахувати кількість розчину, який буде потрібно, щоб розбавити даний розчин до отримання необхідних концентрації та обсягу.[8]- Приклад: необхідно приготувати 75 мілілітрів розчину NaCl концентрації 1,5 M з початкового розчину концентрації 5 M. У цьому прикладі кінцевий обсяг розчину становить 75 мілілітрів.
 Розрахуйте обсяг розчину, який знадобиться для розведення початкового розчину. для цього вам знадобиться наступна формула: V1C1=V2C2, де V1 — обсяг необхідного розчину, C1 — його концентрація, V2 — обсяг кінцевого розчину, C2 — його концентрація.[9]
Розрахуйте обсяг розчину, який знадобиться для розведення початкового розчину. для цього вам знадобиться наступна формула: V1C1=V2C2, де V1 — обсяг необхідного розчину, C1 — його концентрація, V2 — обсяг кінцевого розчину, C2 — його концентрація.[9]- Щоб розрахувати обсяг необхідної рідини, необхідно переписати рівність відносно V1: V1 = (V2C2)/C1.
- Приклад: необхідно приготувати 75 мілілітрів розчин NaCl концентрацією 1,5 M з розчину концентрації 5 M.
- V1 = (V2c2)/C1 = (0,075 л * 1,5 M) / 5M = 0,0225 л.
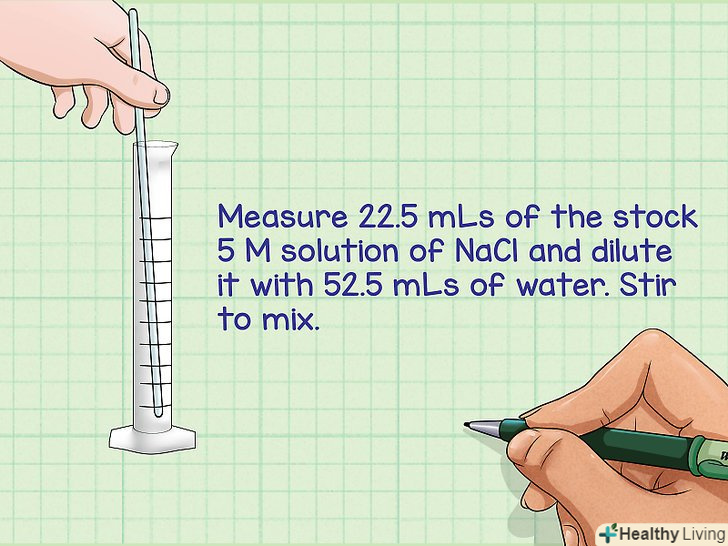
- Переведемо літри назад в мілілітри шляхом множення на 1000 і отримаємо 22,5 мілілітра.
 Віднімемо обсяг вихідного розчину з планованого кінцевого обсягу.в результаті розведення розчину необхідно отримати фіксований кінцевий обсяг. Щоб визначити обсяг розбавляючого розчину, відніміть з кінцевого обсягу обсяг вихідного розчину.
Віднімемо обсяг вихідного розчину з планованого кінцевого обсягу.в результаті розведення розчину необхідно отримати фіксований кінцевий обсяг. Щоб визначити обсяг розбавляючого розчину, відніміть з кінцевого обсягу обсяг вихідного розчину.- Приклад: кінцевий обсяг становить 75 мілілітрів, а вихідний обсяг дорівнює 22,5 мілілітра. Таким чином, отримуємо 75-22,5 = 52,5 мілілітра. Саме такий обсяг рідини знадобиться для розведення розчину.
 Змішайте розраховану кількість вихідного розчину з розбавляючою рідиною.за допомогою мензурки (інструмент для вимірювання об'єму рідини) відміряйте необхідну кількість вихідного розчину і змішайте його з необхідним об'ємом розбавляючої рідини.
Змішайте розраховану кількість вихідного розчину з розбавляючою рідиною.за допомогою мензурки (інструмент для вимірювання об'єму рідини) відміряйте необхідну кількість вихідного розчину і змішайте його з необхідним об'ємом розбавляючої рідини.- Приклад: відміряйте 22,5 мілілітра вихідного розчину NaCl концентрації 5 M і розбавте його 52,5 мілілітрами води. Перемішайте розчин.
- Напишіть на ємності з розведеним розчином його концентрацію і склад: 1,5 M NaCl.
- Пам'ятайте: якщо ви розбавляєте кислоту водою, слід додавати кислоту в воду, але ні в якому разі не навпаки.
Метод4З 4:
Дотримання заходів безпеки
Метод4З 4:
 Використовуйте засоби індивідуального захисту.при роботі з агресивними хімічними речовинами і розчинами слід захиститися від їх впливу. Обов'язково надіньте лабораторний халат, закрите взуття, захисні окуляри і рукавички.
Використовуйте засоби індивідуального захисту.при роботі з агресивними хімічними речовинами і розчинами слід захиститися від їх впливу. Обов'язково надіньте лабораторний халат, закрите взуття, захисні окуляри і рукавички.- Використовуйте лабораторний халат з негорючого матеріалу.
- Захисні окуляри повинні мати бічні щитки, які прикривають очі збоку.
 Працюйте в добре провітрюваному місці.при змішуванні розчинів можуть виділятися леткі гази. З деякими речовинами слід працювати лише під лабораторною витяжкою. Якщо ви змішуєте розчини вдома, відкрийте вікна та увімкніть вентилятор, щоб забезпечити достатню циркуляцію повітря.
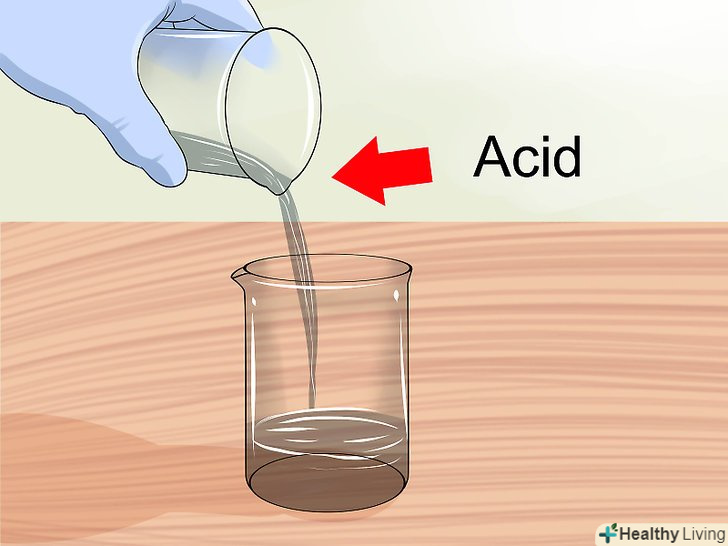
Працюйте в добре провітрюваному місці.при змішуванні розчинів можуть виділятися леткі гази. З деякими речовинами слід працювати лише під лабораторною витяжкою. Якщо ви змішуєте розчини вдома, відкрийте вікна та увімкніть вентилятор, щоб забезпечити достатню циркуляцію повітря. Додайте кислоту у воду.при розведенні концентрованих кислот завжди додавайте кислоту в воду. При змішуванні води і кислоти відбувається екзотермічна (з виділенням теплоти) реакція, що може привести до вибуху в тому випадку, якщо додавати воду в кислоту, а не навпаки.[10]
Додайте кислоту у воду.при розведенні концентрованих кислот завжди додавайте кислоту в воду. При змішуванні води і кислоти відбувається екзотермічна (з виділенням теплоти) реакція, що може привести до вибуху в тому випадку, якщо додавати воду в кислоту, а не навпаки.[10]- Згадуйте заходи безпеки кожен раз, коли вам належить працювати з кислотами.
Поради
- Перш ніж приступити до роботи, ознайомтеся з предметом. Знання-сила!
- Спробуйте використовувати звичайні побутові речовини. Не намагайтеся зробити що-небудь екстраординарне. Якщо ви підозрюєте, що може виникнути небезпека, відмовтеся від задуманого.
Попередження
- Не змішуйте відбілювач і аміак.
- При необхідності використовуйте засоби безпеки, захисні окуляри, пластиковий фартух і неопренові рукавички.
Що вам знадобиться
- точні механічні або електронні ваги, щоб визначити масу. Наприклад, можна використовувати кухонні ваги.
- проградуйований скляний посуд. Такий посуд можна знайти в магазині кухонного начиння або замовити через Інтернет. Вимірювальний посуд відрізняється різноманітністю форм і розмірів. Підійде пластиковий посуд, хоча вона не витримує високих температур.
Джерела
- ↑ Http://www.mgel.msstate.edu/pdf/solutions.pdf
- ↑ Http://www.mgel.msstate.edu/pdf/solutions.pdf
- ↑ Http://www.mgel.msstate.edu/pdf/solutions.pdf
- ↑ Http://abacus.bates.edu/~ganderso/biology/resources/dilutions.html
- ↑ Http://abacus.bates.edu/~ganderso/biology/resources/dilutions.html
- ↑ Http://abacus.bates.edu/~ganderso/biology/resources/dilutions.html
- ↑ Http://www.mgel.msstate.edu/pdf/solutions.pdf
- ↑ Http://www.mgel.msstate.edu/pdf/solutions.pdf
- ↑ Http://www.mgel.msstate.edu/pdf/solutions.pdf