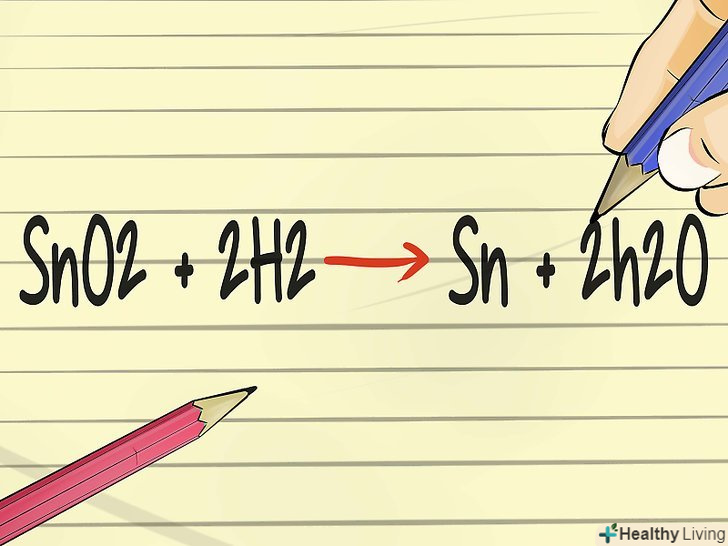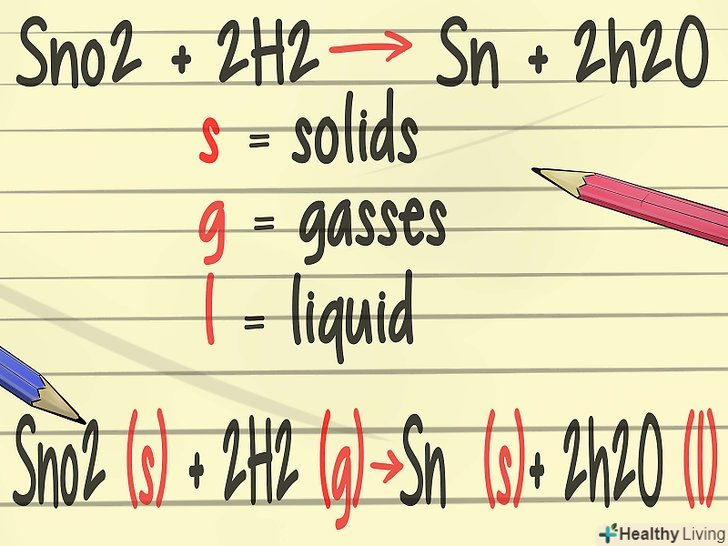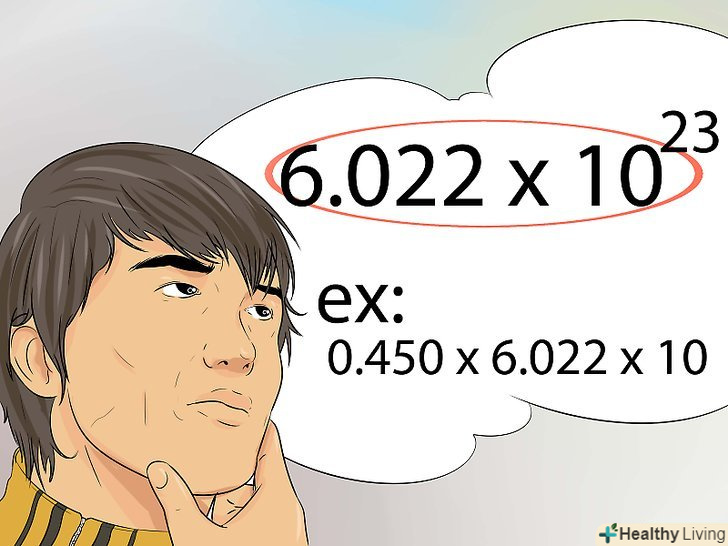Щоб успішно скласти іспит з загальної хімії, важливо знати основи предмета, вміти рахувати, використовувати калькулятор для більш складних завдань і бути готовим дізнатися щось нове. Хімія вивчає речовини і їх властивості. Все навколо нас пов'язано з хімією, навіть найпростіші речі, які ми приймаємо як належне, - наприклад, вода, яку ми п'ємо, і повітря, яким ми дихаємо. Будьте готові до відкриттів про все, що вас оточує. Знайомство з хімією буде захоплюючим.
Кроки
Метод1З 5:
Корисні звички в навчанні
Метод1З 5:
 Познайомтеся з викладачем або вчителем.щоб успішно скласти іспит, слід познайомитися з викладачем і розповісти йому, що вам дається важко.
Познайомтеся з викладачем або вчителем.щоб успішно скласти іспит, слід познайомитися з викладачем і розповісти йому, що вам дається важко.- До багатьох викладачів можна підійти поза уроками, якщо студентам потрібна допомога. Крім того, у них зазвичай є методичні видання.
 Зберіть групу для занять.не соромтеся того, що хімія дається вам важко. Цей предмет складний практично для всіх.
Зберіть групу для занять.не соромтеся того, що хімія дається вам важко. Цей предмет складний практично для всіх.- Працюючи в групі, люди, які зможуть швидко зрозуміти якусь тему, пояснять її іншим. Розділяйте і володарюйте.
 Прочитайте потрібні параграфи в підручнику.підручник з хімії - не саме захоплююче чтиво, але вам слід уважно ознайомитися з матеріалом і виділити текст, який вам не зрозумілий. Складіть список питань і понять, які вам складно зрозуміти.
Прочитайте потрібні параграфи в підручнику.підручник з хімії - не саме захоплююче чтиво, але вам слід уважно ознайомитися з матеріалом і виділити текст, який вам не зрозумілий. Складіть список питань і понять, які вам складно зрозуміти.- Поверніться до цих частин пізніше зі свіжою головою. Якщо вам все одно важко, обговоріть тему в групі або зверніться за допомогою до викладача.
 Дайте відповідь на питання після параграфа.навіть якщо матеріалу багато, ви, можливо, запам'ятали більше, ніж вам здається. Постарайтеся відповісти на питання в кінці глави.
Дайте відповідь на питання після параграфа.навіть якщо матеріалу багато, ви, можливо, запам'ятали більше, ніж вам здається. Постарайтеся відповісти на питання в кінці глави.- Іноді в підручниках є пояснювальні матеріали в кінці, які описують правильне рішення. Це допоможе вам зрозуміти, де ви зробили помилку в міркуваннях.
 Вивчіть діаграми, зображення та таблиці.у підручниках використовуються наочні способи передачі інформації.
Вивчіть діаграми, зображення та таблиці.у підручниках використовуються наочні способи передачі інформації.- Подивіться на зображення та схеми. Це дозволить краще зрозуміти деякі концепції.
 Попросіть у викладача дозволу записувати лекцію на диктофон.складно записувати інформацію і при цьому дивитися на дошку, особливо якщо мова йде про такий непростий предмет, як хімія.
Попросіть у викладача дозволу записувати лекцію на диктофон.складно записувати інформацію і при цьому дивитися на дошку, особливо якщо мова йде про такий непростий предмет, як хімія. Ознайомтеся з питаннями попередніх іспитів.іноді студентам видають питання, які зустрічалися на іспитах в минулі роки, щоб вони могли краще підготуватися.
Ознайомтеся з питаннями попередніх іспитів.іноді студентам видають питання, які зустрічалися на іспитах в минулі роки, щоб вони могли краще підготуватися.- Не заучуйте відповіді. Хімія-це предмет, де для відповіді на питання важливо розуміти, про що йде мова, а не тільки повторювати завчений текст.
 Скористайтеся навчальними онлайн-ресурсами. Відвідайте всі сайти, які рекомендує викладач.
Скористайтеся навчальними онлайн-ресурсами. Відвідайте всі сайти, які рекомендує викладач.
Метод2З 5:
Розуміння атомістичної будови
Метод2З 5:
 Почніть з найпростішого будови. щоб стати іспит, вам потрібно буде знати, з чого складається все, що є речовиною і має масу.
Почніть з найпростішого будови. щоб стати іспит, вам потрібно буде знати, з чого складається все, що є речовиною і має масу.- Все починається з розуміння будови атома. Все інше буде додаватися зверху. Важливо дуже ретельно вивчити всю інформацію про атом.
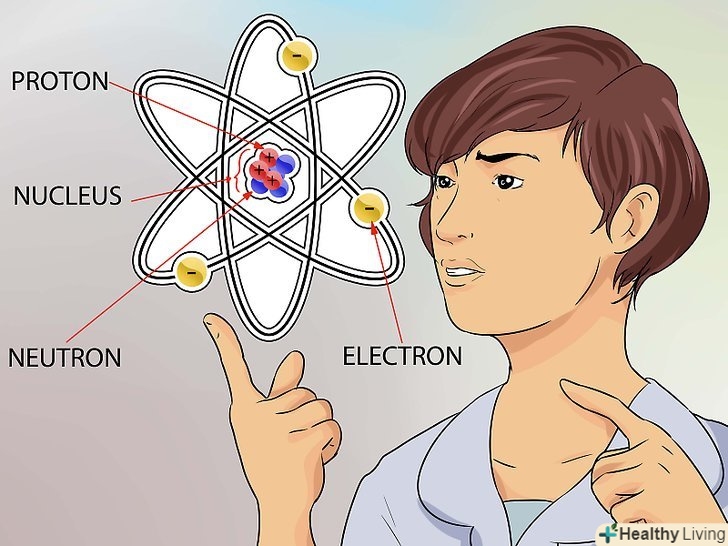
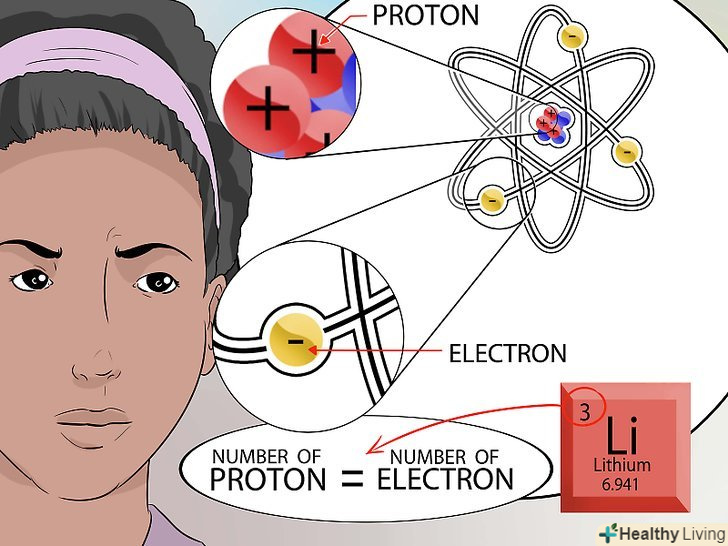
 Ознайомтеся з концепцією атома.атом - це найдрібніших "цеглинка" всього, у чого є маса, включаючи речовини, які ми не завжди можемо побачити (наприклад, гази). Але навіть в атомі є найдрібніші частинки, які формують його структуру.[1].
Ознайомтеся з концепцією атома.атом - це найдрібніших "цеглинка" всього, у чого є маса, включаючи речовини, які ми не завжди можемо побачити (наприклад, гази). Але навіть в атомі є найдрібніші частинки, які формують його структуру.[1].- Атом складається з трьох частин-нейтрони, протони і електрони. Центр атома називається ядром. Ядро складається з нейтронів і протонів. Електрони-це частинки, які обертаються навколо зовнішньої оболонки атома як планети навколо Сонця.[2]
- Атом дуже маленький. Уявіть собі найбільший стадіон з усіх відомих вам. Якщо стадіон-це атом, то ядро цього атома має розмір горошини.[3]
 Дізнайтеся, що являє собою атомна структура елемента. елемент-це речовина в природі, яке не можна розщепити на більш дрібні речовини. Елементи складаються з атомів.[4]
Дізнайтеся, що являє собою атомна структура елемента. елемент-це речовина в природі, яке не можна розщепити на більш дрібні речовини. Елементи складаються з атомів.[4]- Атоми в елементі не змінюються. Це означає, що кожен елемент має певну унікальну кількість нейтронів і протонів у його атомній структурі.[5]
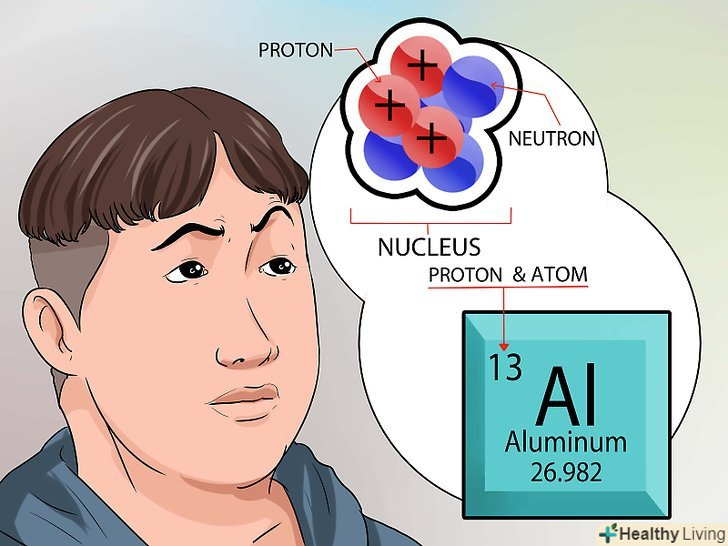
 З'ясуйте, як влаштовано ядро.нейтрони в ядрі володіють нейтральним зарядом. У протонів позитивний заряд. Атомне число елемента дорівнює кількості протонів в ядрі.[6].
З'ясуйте, як влаштовано ядро.нейтрони в ядрі володіють нейтральним зарядом. У протонів позитивний заряд. Атомне число елемента дорівнює кількості протонів в ядрі.[6].- Немає необхідності вважати кількість протонів в ядрі. Це число вказується в періодичній таблиці хімічних елементів для кожного елемента.
 Порахуйте кількість нейтронів в ядрі. можна використовувати число з періодичної таблиці. Атомне число елемента збігається з кількістю протонів в ядрі.
Порахуйте кількість нейтронів в ядрі. можна використовувати число з періодичної таблиці. Атомне число елемента збігається з кількістю протонів в ядрі.- Атомна маса вказується внизу квадрата кожного елемента під його назвою.
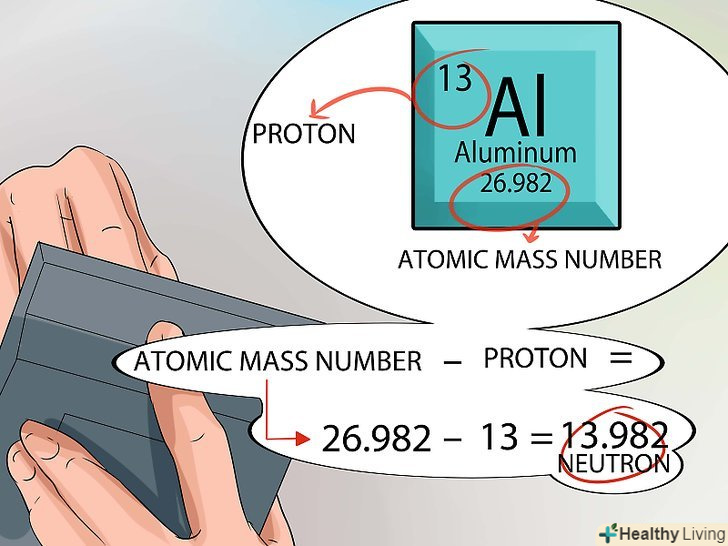
- Пам'ятайте, що в ядрі атома є лише протони і нейтрони. У періодичній системі вказано кількість протонів і значення атомної маси.
- Тепер порахувати все буде просто. Відніміть кількість протонів від атомної маси, і ви отримаєте кількість нейтронів в ядрі кожного атома елемента.[7]
 Порахуйте кількість електронів.Пам'ятайте, що частинки з протилежними зарядами притягуються. Електрони мають позитивний заряд і крутяться навколо атома. Кількість негативно заряджених електронів, які притягуються до ядра, залежить від кількості позитивно заряджених протонів в ядрі.
Порахуйте кількість електронів.Пам'ятайте, що частинки з протилежними зарядами притягуються. Електрони мають позитивний заряд і крутяться навколо атома. Кількість негативно заряджених електронів, які притягуються до ядра, залежить від кількості позитивно заряджених протонів в ядрі.- Оскільки сам атом володіє нейтральним зарядом, кількість частинок з негативним зарядом має дорівнювати кількості частинок з позитивним зарядом. З цієї причини кількість електронів дорівнює кількості протонів.[8]
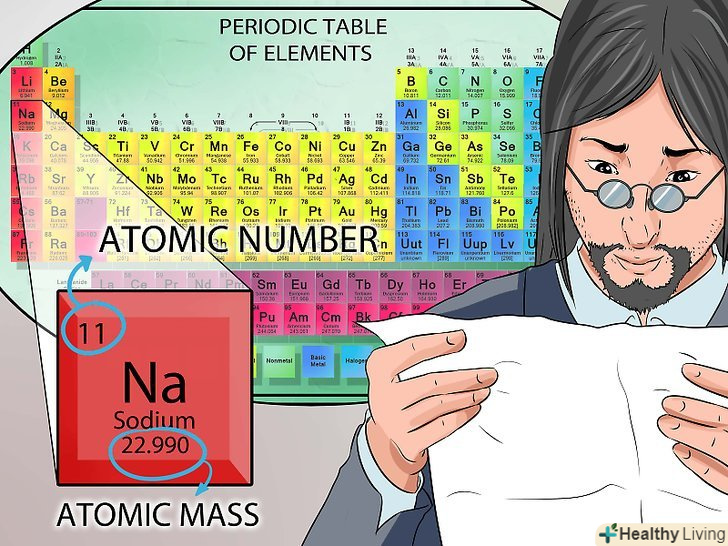
 Зверніться до періодичної системи елементів.якщо вам важко даються властивості елементів, вивчіть всю доступну інформацію про періодичну таблицю.
Зверніться до періодичної системи елементів.якщо вам важко даються властивості елементів, вивчіть всю доступну інформацію про періодичну таблицю.- Розуміння періодичної таблиці важливо для успішного складання іспиту.
- Періодична система складається тільки з елементів. У кожного елемента є буквений символ, цей символ завжди позначає цей елемент. Наприклад, Na-це завжди натрій. Повна назва елемента розміщується під літерним символом.[9]
- Число над літерним символом-це атомне число. Воно дорівнює кількості протонів в ядрі.[10]
- Число під літерним символом-це атомна маса. Пам'ятайте, що атомна маса-це сума протонів і нейтронів в ядрі.[11]
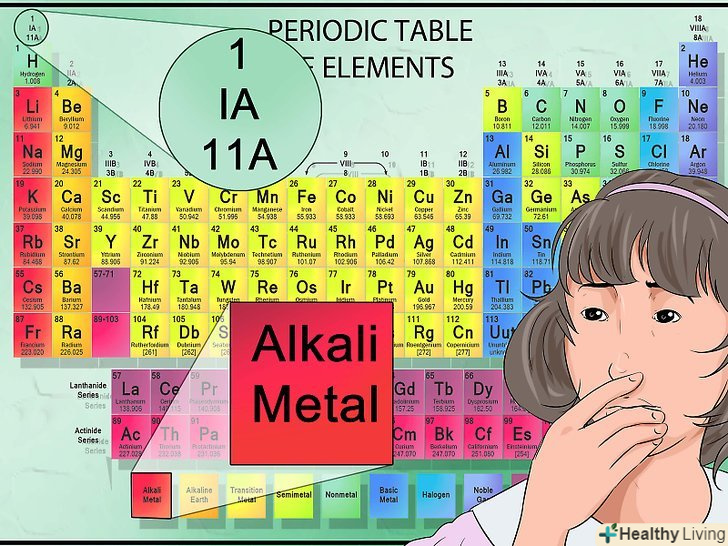
 Навчіться читати таблицю.у таблиці багато інформації, від кольорів колонок до розташування елементів зліва направо і зверху вниз.
Навчіться читати таблицю.у таблиці багато інформації, від кольорів колонок до розташування елементів зліва направо і зверху вниз.
Метод3З 5:
Розрахунок хімічних реакцій
Метод3З 5:
 Напишіть рівняння.на заняттях з хімії вас будуть вчити визначати, що станеться з елементами при їх з'єднанні. На папері це називається рішенням рівняння.[12]
Напишіть рівняння.на заняттях з хімії вас будуть вчити визначати, що станеться з елементами при їх з'єднанні. На папері це називається рішенням рівняння.[12]- Хімічне рівняння складається з речовин з лівого боку, стрілочки і продукту реакції. Речовини з одного боку рівняння повинні врівноважувати речовини з іншого боку.[13]
- Наприклад, речовина 1 + речовина 2 → продукт 1 + продукт 2.
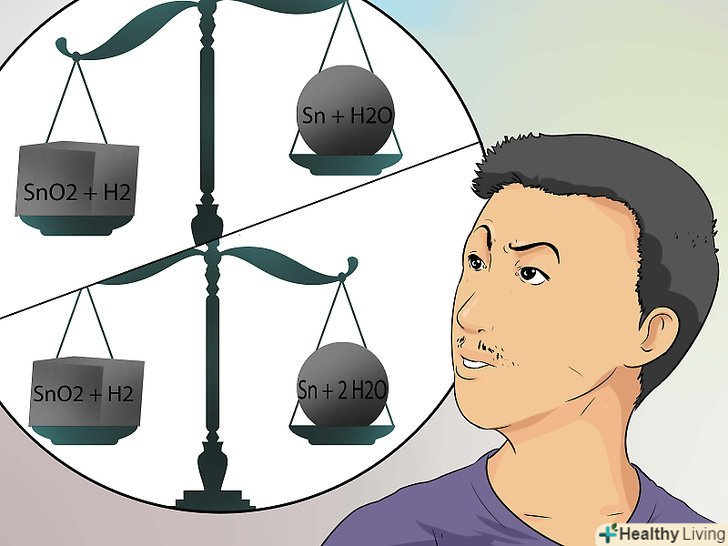
- Візьмемо олово (Sn) в окисленій формі (SnO2) і з'єднаємо з воднем у формі газу (H2). SnO2 + H2 → Sn + H2O.
- Це рівняння необхідно балансувати, оскільки кількість речовин-реагентів має дорівнювати кількості отриманих продуктів. У лівій частині більше атомів кисню, ніж у правій.[14]
- Підставимо дві одиниці водню зліва і дві молекули води справа. У фінальній версії збалансоване рівняння виглядає так: SnO2 + 2 H2 → Sn + 2 H2O.[15]
 Подумайте про рівняння по-новому.якщо вам складно балансувати рівняння, уявіть, що це рецепт, але його потрібно скорегувати з обох сторін.
Подумайте про рівняння по-новому.якщо вам складно балансувати рівняння, уявіть, що це рецепт, але його потрібно скорегувати з обох сторін.- У завданні вам дані інгредієнти з лівого боку, але не сказано, скільки їх потрібно брати. У рівнянні також сказано, що вийде, але не сказано, в яких кількостях. Вам потрібно з'ясувати це.
- На прикладі попереднього рівняння, SnO2 + H2 → Sn + H2O, подумаємо, чому така формула не буде працювати. Кількість Sn дорівнює з двох сторін, як і кількість H2, однак зліва дві частини кисню, а праворуч - лише одна.
- Необхідно змінити праву частину рівняння так, щоб в отриманому продукті було дві частини H2O. двійка перед H2O означає, що всі кількості будуть збільшені в два рази. Тепер кисень збалансований, однак двійка означає, що справа тепер більше водню, ніж зліва. Поверніться до лівої частини і збільште водень в два рази, поставивши перед ним двійку.
- Тепер все врівноважено. Кількості на вході рівні кількостям на виході.
 Додайте більше деталей до рівняння. на заняттях з хімії ви познайомитеся з символами, які позначають фізичний стан елементів: т - тверде, г - газ, ж - рідина. [16]
Додайте більше деталей до рівняння. на заняттях з хімії ви познайомитеся з символами, які позначають фізичний стан елементів: т - тверде, г - газ, ж - рідина. [16] Навчіться визначати зміни, які відбуваються при хімічній реакції.хімічні реакції починаються з базових елементів або сполук, які вступають в реакцію. В результаті з'єднання виходить продукт реакції або кілька продуктів.
Навчіться визначати зміни, які відбуваються при хімічній реакції.хімічні реакції починаються з базових елементів або сполук, які вступають в реакцію. В результаті з'єднання виходить продукт реакції або кілька продуктів.- Щоб скласти іспит, потрібно знати, як вирішувати рівняння, в яких містяться реактанти або продукти з'єднань або і те, і інше.[17]
 Вивчіть різні типи реакцій.хімічні реакції можуть відбуватися під впливом різних факторів, а не тільки при з'єднанні елементів.
Вивчіть різні типи реакцій.хімічні реакції можуть відбуватися під впливом різних факторів, а не тільки при з'єднанні елементів.- До найбільш поширених типів реакцій відносяться синтез, аналіз, заміщення, подвійне розкладання, реакція між кислотами і підставами, окислення-відновлення, горіння, ізомеризація, гідроліз.[18]
- На заняттях можуть вивчатися різні реакції-все залежить від цілей курсу. В університеті ступінь поглиблення в матеріал буде відрізнятися від шкільної програми.
 Використовуйте всі доступні ресурси.вам потрібно буде зрозуміти різницю між основними реакціями. Використовуйте всі можливі матеріали, щоб зрозуміти цю різницю. Не бійтеся задавати питання.
Використовуйте всі доступні ресурси.вам потрібно буде зрозуміти різницю між основними реакціями. Використовуйте всі можливі матеріали, щоб зрозуміти цю різницю. Не бійтеся задавати питання.- Зрозуміти, що змінюється при хімічних реакціях, не так просто. Це буде однією з найскладніших завдань на заняттях з хімії.
 Осмисліть реакції з точки зору логіки.постарайтеся не заплутатися в термінології і не зробити все ще складніше. Всі реакції спрямовані на перетворення чогось в щось інше.
Осмисліть реакції з точки зору логіки.постарайтеся не заплутатися в термінології і не зробити все ще складніше. Всі реакції спрямовані на перетворення чогось в щось інше.- Наприклад, ви вже знаєте, що вийде, якщо з'єднати два атома водню і один атом кисню, - вода. Тому якщо налити воду в каструлю і поставити на вогонь, щось зміниться. Ви провели хімічну реакцію. Якщо поставити воду в холодильник, відбудеться реакція. Ви змінили щось, що залучило речовину, що бере участь у реакції, тобто воду.
- Пройдіться по кожному типу реакції, поки не зрозумієте все. Сконцентруйтеся на джерелі енергії, який провокує реакцію, і основних змінах, які стають результатом реакції.
- Якщо вам складно розібратися в цьому, складіть список незрозумілих нюансів і покажіть його викладачеві, однокурсникам або будь-якій людині, яка добре розбирається в хімії.
Метод4З 5:
Розрахунки
Метод4З 5:
 Знайте послідовність основних обчислень.у хімії іноді потрібні дуже точні розрахунки, але часто досить базових знань математики. Важливо розуміти, в якій послідовності здійснюються розрахунки.[19]
Знайте послідовність основних обчислень.у хімії іноді потрібні дуже точні розрахунки, але часто досить базових знань математики. Важливо розуміти, в якій послідовності здійснюються розрахунки.[19]- Спочатку робляться розрахунки в дужках, потім обчислення в ступенях, потім множення або ділення і в кінці - додавання або віднімання.
- У прикладі 3 + 2 x 6 = ___ правильною відповіддю буде 15.
 Не бійтеся округляти дуже довгі числа.у хімії часто округлюють, тому що нерідко відповіддю на рівняння служить число з великою кількістю цифр. Якщо в умові завдання дані інструкції по округленню, врахуйте їх.[20]
Не бійтеся округляти дуже довгі числа.у хімії часто округлюють, тому що нерідко відповіддю на рівняння служить число з великою кількістю цифр. Якщо в умові завдання дані інструкції по округленню, врахуйте їх.[20]- Знайте, як округляти. Якщо наступна цифра-це 4 або менше, слід округляти до меншого, якщо 5 і більше 5 - до більшого. Наприклад, перед вами число 6.66666666666666. У завданні сказано округлити відповідь до другої цифри після точки. Відповіддю буде 6.67.[21]
 Зрозумійте, що таке абсолютне значення.у хімії у деяких чисел є абсолютне, а не математичне значення. Абсолютне значення-це все значення до числа від нуля.
Зрозумійте, що таке абсолютне значення.у хімії у деяких чисел є абсолютне, а не математичне значення. Абсолютне значення-це все значення до числа від нуля.- Іншими словами, у вас більше немає негативних і позитивних значень, є тільки Відстань до нуля. Наприклад, абсолютним значенням -20 є 20.[22]
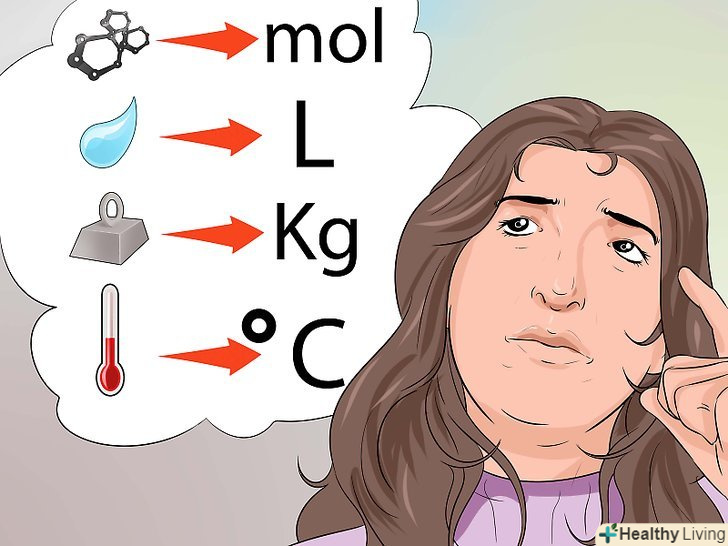
 Знайте всі поширені одиниці виміру. Ось кілька прикладів.
Знайте всі поширені одиниці виміру. Ось кілька прикладів.- Кількість речовини вимірюється в молях (mol).
- Температура вимірюється в градусах за Фаренгейтом (°F), Кельвіном (°K) або Цельсієм (°C).
- Маса вимірюється в грамах (г), кілограмах (кг) або в міліграмах (мг).
- Обсяг рідини вимірюють в літрах (л) або мілілітрах (мл).
 Потренуйтеся переводити значення з однієї системи вимірювання в іншу.на іспиті вам доведеться займатися такими перекладами. Можливо, вам потрібно буде перевести температуру з однієї системи в іншу, фунти - в кілограми, Унції - в літри.
Потренуйтеся переводити значення з однієї системи вимірювання в іншу.на іспиті вам доведеться займатися такими перекладами. Можливо, вам потрібно буде перевести температуру з однієї системи в іншу, фунти - в кілограми, Унції - в літри.- Вас можуть попросити дати відповідь в одиницях, відмінних від одиниць в умові завдання. Наприклад, в тексті завдання температура буде вказана в градусах за Цельсієм, а відповідь потрібна буде в градусах за Кельвіном.
- Зазвичай температуру хімічних реакцій вимірюють в градусах по Кельвіну. Потренуйтеся переводити градуси за Цельсієм в градуси за Фаренгейтом або Кельвіном.
 Не поспішайте.вдумливо прочитайте текст завдання і навчитеся переводити одиниці виміру.
Не поспішайте.вдумливо прочитайте текст завдання і навчитеся переводити одиниці виміру. Вмійте розраховувати концентрацію.Відточіть знання основ математики, розраховуючи відсотки, співвідношення і пропорції.
Вмійте розраховувати концентрацію.Відточіть знання основ математики, розраховуючи відсотки, співвідношення і пропорції. Попрактикуйтесь на даних про харчову цінність продуктів на упаковках.щоб здати хімію, вам потрібно вміти розраховувати співвідношення, пропорції і відсотки в різних послідовностях. Якщо вам це складно, почніть тренуватися на звичних одиницях виміру (наприклад, на упаковках харчових продуктів).
Попрактикуйтесь на даних про харчову цінність продуктів на упаковках.щоб здати хімію, вам потрібно вміти розраховувати співвідношення, пропорції і відсотки в різних послідовностях. Якщо вам це складно, почніть тренуватися на звичних одиницях виміру (наприклад, на упаковках харчових продуктів).- Візьміть упаковку з даними про харчову цінність. Ви побачите розрахунок калорій на порцію, рекомендовану порцію продукту в день у відсотках, загальна кількість жиру, відсоток калорій від жиру, загальна кількість вуглеводів і розбивку за типами вуглеводів. Навчіться вираховувати різні співвідношення, відштовхуючись від цих значень.
- Наприклад, розрахуйте кількість мононенасиченого жиру в загальній кількості жирів. Переведіть в процентне співвідношення. Розрахуйте, скільки калорій міститься в упаковці, знаючи кількість порцій і калорійність кожної порції. Розрахуйте, скільки натрію міститься в половині упаковки.
- Це допоможе вам з легкістю переводити хімічні значення з однієї системи в одному, наприклад, молі на літр, грами на моль і так далі.

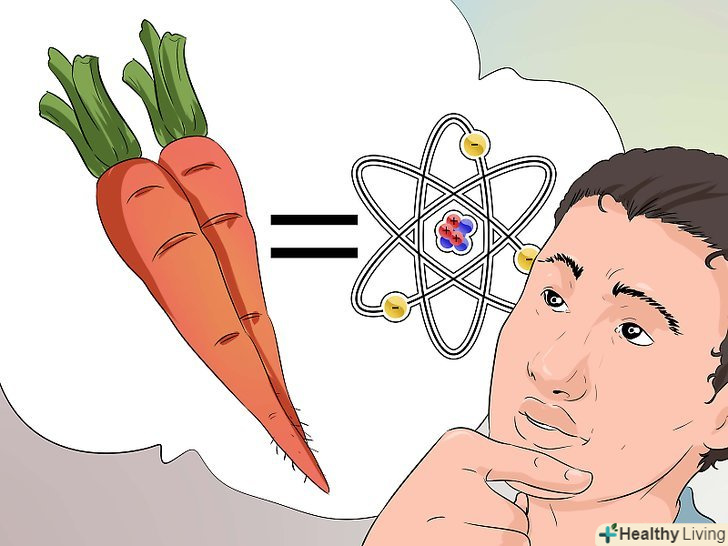
 Подумайте про морквину.якщо вам складно зрозуміти, як використовувати число Авогадро, спробуйте рахувати моркву, а не атоми, молекули або частинки. Скільки морквин міститься в дюжині? Ми знаємо, що дюжина-це 12, значить, в одній дюжині 12 морквин.
Подумайте про морквину.якщо вам складно зрозуміти, як використовувати число Авогадро, спробуйте рахувати моркву, а не атоми, молекули або частинки. Скільки морквин міститься в дюжині? Ми знаємо, що дюжина-це 12, значить, в одній дюжині 12 морквин.- Тепер відповімо на питання, скільки морквин міститься в молі. Замість того щоб помножити на 12, ми помножимо на число Авогадро. У молі 6.022 x 1023 морквин.
- Число Авогадро використовується для конвертації будь-якого значення атомів, молекул, частинок або морквин в молі.
- Якщо ви знаєте кількість молей речовини, значить, значення числа молекул, атомів або частинок буде дорівнювати цьому числу, помноженому на число Авогадро.[25]
- Розуміння того, як частинки переводяться в молі, є важливим фактором на іспиті. Конвертації в молі-це частина розрахунків співвідношень і пропорцій. Це означає кількість чогось у молях як частину чогось іншого.
 Розберіться в молярності.Подумайте про кількість молей речовини, що міститься в рідині. Дуже важливо зрозуміти цей приклад, оскільки мова йде про молярності, тобто про пропорції речовини, вираженого в молях на літр.
Розберіться в молярності.Подумайте про кількість молей речовини, що міститься в рідині. Дуже важливо зрозуміти цей приклад, оскільки мова йде про молярності, тобто про пропорції речовини, вираженого в молях на літр.- Молярність, або молярна концентрація, - це термін, який виражає кількість якоїсь речовини в рідині, тобто кількість розчиненої речовини в розчині. Щоб отримати молярність, потрібно розділити молі розчиненої речовини на літри розчину. Молярність виражається в молях на літр.[26]
- Розрахуйте щільність. Щільність часто використовується в хімії. Щільність-це маса хімічної речовини на одиницю об'єму. Зазвичай щільність виражається в грамах на мілілітр або в грамах на кубічний сантиметр - це те ж саме.[27]

 Знайте, що включається в молекулярну формулу.молекулярну формулу не потрібно доводити до найпростішої, або емпіричної, форми, оскільки в ній сказано, з чого саме складається молекула.
Знайте, що включається в молекулярну формулу.молекулярну формулу не потрібно доводити до найпростішої, або емпіричної, форми, оскільки в ній сказано, з чого саме складається молекула.- Молекулярна формула записується за допомогою абревіатур елементів і кількості атомів кожного елемента в молекулі.
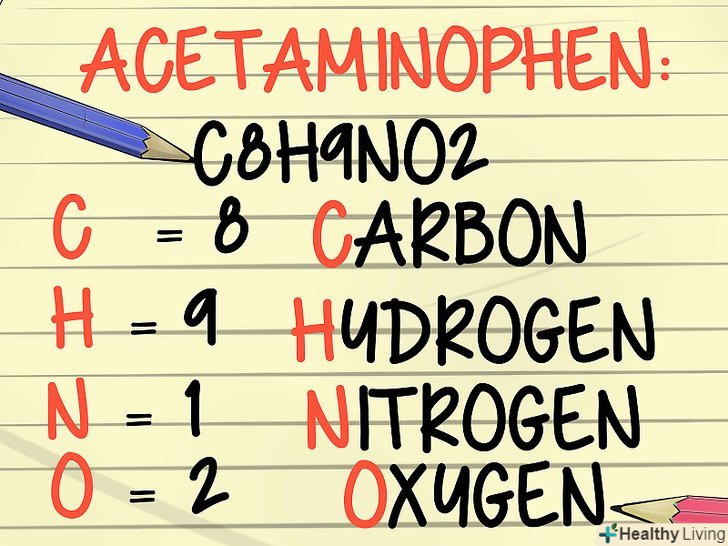
- Наприклад, Молекулярна формула води-це H2O. це означає, що в кожній молекулі води міститься два атоми водню і один атом кисню. Молекулярна формула ацетамінофену-C8H9NO2. Кожна хімічна сполука має молекулярну формулу.
 Пам'ятайте, що математика в хімії називається стехіометрією. ви зустрінете цей термін. Це опис того, як хімія виражається в математичних формулах. У хімічній математиці, або в стехіометрії, кількості елементів і хімічних сполук часто виражаються в молях, відсотках в молях, в молях на літр або в молях на кілограм.[30]
Пам'ятайте, що математика в хімії називається стехіометрією. ви зустрінете цей термін. Це опис того, як хімія виражається в математичних формулах. У хімічній математиці, або в стехіометрії, кількості елементів і хімічних сполук часто виражаються в молях, відсотках в молях, в молях на літр або в молях на кілограм.[30]- Вам потрібно буде переводити грами в молі. Атомна маса одиниці елемента в грамах дорівнює одному молю цієї речовини. Наприклад, атомна маса кальцію-40 одиниць атомної маси. Таким чином, 40 грамів кальцію дорівнюють одному молю кальцію.[31]