Атомною масою називається сума мас всіх протонів, нейтронів і електронів, з яких складається той чи інший атом або молекула.[1] у порівнянні з протонами і нейтронами маса електронів дуже мала, тому вона не враховується в розрахунках.[2] хоча це і некоректно з формальної точки зору, нерідко даний термін використовується для позначення середньої атомної маси всіх ізотопів елемента. Насправді це відносна атомна маса, звана також атомною вагою елемента.[3] атомна вага-це середнє значення атомних мас всіх ізотопів елемента, що зустрічаються в природі. Хіміки повинні розрізняти ці два типи атомної маси при виконанні своєї роботи-неправильне значення атомної маси може, наприклад, привести до неправильного результату для виходу продукту реакції.
Кроки
Метод1З 3:
Знаходження атомної маси за періодичною таблицею елементів
 Вивчіть як записується атомна маса.атомна маса, тобто маса даного атома або молекули, може бути виражена в стандартних одиницях системи СІ – грамах, кілограмах і так далі. Однак у зв'язку з тим, що атомні маси, виражені в цих одиницях, надзвичайно малі, їх часто записують в уніфікованих атомних одиницях маси, або скорочено а.е.м. – атомні одиниці маси. Одна Атомна одиниця маси дорівнює 1/12 маси стандартного ізотопу вуглець-12.[4]
Вивчіть як записується атомна маса.атомна маса, тобто маса даного атома або молекули, може бути виражена в стандартних одиницях системи СІ – грамах, кілограмах і так далі. Однак у зв'язку з тим, що атомні маси, виражені в цих одиницях, надзвичайно малі, їх часто записують в уніфікованих атомних одиницях маси, або скорочено а.е.м. – атомні одиниці маси. Одна Атомна одиниця маси дорівнює 1/12 маси стандартного ізотопу вуглець-12.[4]- Атомна одиниця маси характеризує масуодного моля даного елемента в грамах. Ця величина дуже корисна при практичних розрахунках, оскільки з її допомогою можна легко перевести масу заданої кількості атомів або молекул даної речовини в молі, і навпаки.
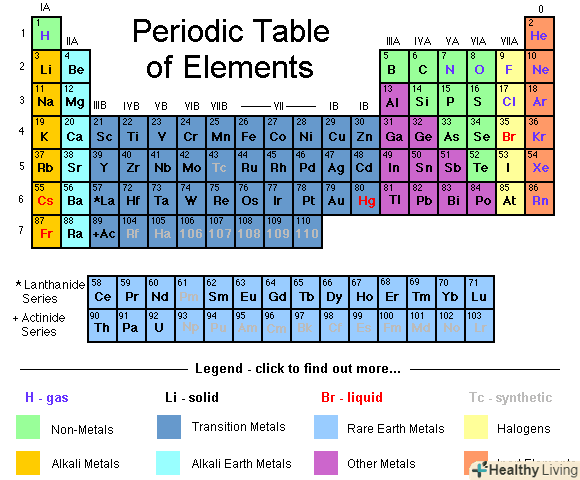
 Знайдіть атомну масу в періодичній таблиці Менделєєва.у більшості стандартних таблиць Менделєєва містяться атомні маси (атомні ваги) кожного елемента. Як правило, вони наведені у вигляді числа в нижній частині комірки з елементом, під буквами, що позначають хімічний елемент. Зазвичай це не ціле число, а десятковий дріб.
Знайдіть атомну масу в періодичній таблиці Менделєєва.у більшості стандартних таблиць Менделєєва містяться атомні маси (атомні ваги) кожного елемента. Як правило, вони наведені у вигляді числа в нижній частині комірки з елементом, під буквами, що позначають хімічний елемент. Зазвичай це не ціле число, а десятковий дріб.- Зверніть увагу, що всі відносні атомні маси, зазначені в таблиці Менделєєва, для кожного елемента єсередніми значеннями. У хімічних елементів є різні ізотопи - хімічні різновиди, що мають різні маси через додаткових або відсутніх нейтронів в атомному ядрі.[5] отже, відносні атомні маси, перераховані в періодичній таблиці, можуть використовуватися як середнє значення для атомів певного елемента, але Не як маса одного атома даного елемента.
- Відносні атомні маси, наведені в періодичній таблиці, використовуються для розрахунку молярних мас атомів і молекул. Атомні маси, виражені в А. е. м. (як в таблиці Менделєєва), по суті безрозмірні. Однак просто помноживши атомну масу на 1 г/моль, ми отримуємо корисну характеристику елемента – масу (в грамах) одного моля атомів цього елемента.
 Пам'ятайте про те, що в періодичній таблиці наведені середні атомні маси елементів. як було зазначено раніше, відносні атомні маси, зазначені для кожного елемента в періодичній системі, є середніми значеннями мас всіх ізотопів атома. Це середнє значення цінне для багатьох практичних цілей: наприклад, воно використовується при розрахунку молярної маси молекул, що складаються з декількох атомів. Однак коли ви маєте справу з окремими атомами, цього значення, як правило, буває недостатньо.
Пам'ятайте про те, що в періодичній таблиці наведені середні атомні маси елементів. як було зазначено раніше, відносні атомні маси, зазначені для кожного елемента в періодичній системі, є середніми значеннями мас всіх ізотопів атома. Це середнє значення цінне для багатьох практичних цілей: наприклад, воно використовується при розрахунку молярної маси молекул, що складаються з декількох атомів. Однак коли ви маєте справу з окремими атомами, цього значення, як правило, буває недостатньо.- Оскільки середня атомна маса являє собою усереднене значення для декількох ізотопів, величина, зазначена в таблиці Менделєєва не єточним значенням атомної маси будь-якого одиничного атома.
- Атомні маси окремих атомів необхідно розраховувати з урахуванням точного числа протонів і нейтронів в одиничному атомі.
Метод2 З 3:
Розрахунок атомної маси окремого атома
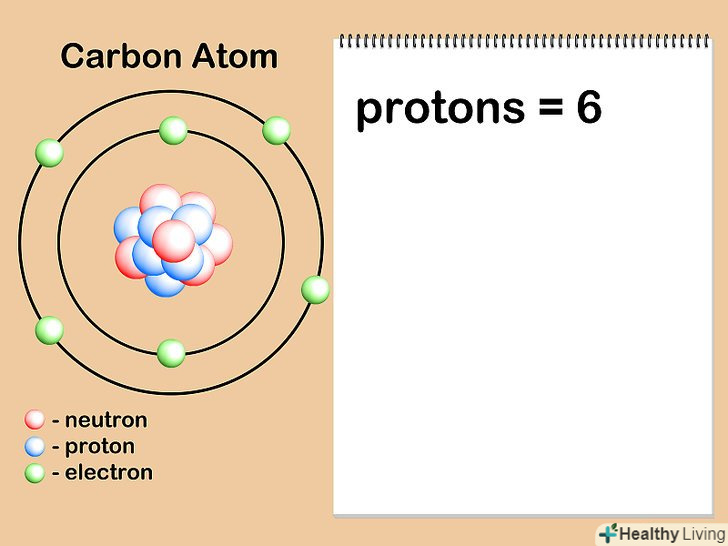
 Знайдіть атомний номер даного елемента або його ізотопу.атомний номер-це кількість протонів в атомах елемента, воно ніколи не змінюється.[6] наприклад, всі атоми водню, причому тільки вони, мають один протон. Атомний номер натрію дорівнює 11, оскільки в його ядрі одинадцять протонів, тоді як атомний номер кисню становить вісім, так як в його ядрі вісім протонів. Ви можете знайти атомний номер будь – якого елемента в періодичній таблиці Менделєєва-практично у всіх її стандартних варіантах цей номер вказаний над літерним позначенням хімічного елемента. Атомний номер завжди є позитивним цілим числом.
Знайдіть атомний номер даного елемента або його ізотопу.атомний номер-це кількість протонів в атомах елемента, воно ніколи не змінюється.[6] наприклад, всі атоми водню, причому тільки вони, мають один протон. Атомний номер натрію дорівнює 11, оскільки в його ядрі одинадцять протонів, тоді як атомний номер кисню становить вісім, так як в його ядрі вісім протонів. Ви можете знайти атомний номер будь – якого елемента в періодичній таблиці Менделєєва-практично у всіх її стандартних варіантах цей номер вказаний над літерним позначенням хімічного елемента. Атомний номер завжди є позитивним цілим числом.- Припустимо, нас цікавить атом вуглецю. В атомах вуглецю завжди шість протонів, тому ми знаємо, що його атомний номер дорівнює 6. Крім того, ми бачимо, що в періодичній системі, у верхній частині осередку з вуглецем (C) знаходиться цифра "6", що вказує на те, що атомний номер вуглецю дорівнює шести.
- Зверніть увагу, що атомний номер елемента не пов'язаний однозначно з його відносною атомною масою в періодичній системі. Хоча, особливо для елементів у верхній частині таблиці, може здатися, що атомна маса елемента вдвічі більше його атомного номера, вона ніколи не розраховується множенням атомного номера на два.
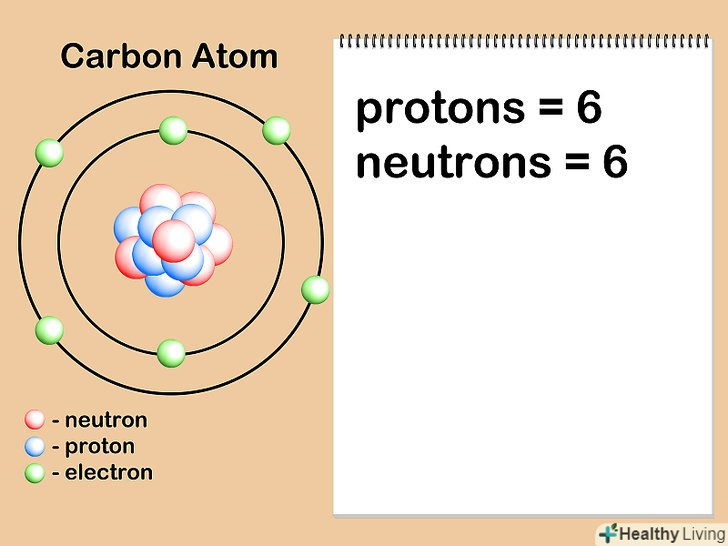
 Знайдіть число нейтронів в ядрі.кількість нейтронів може бути різною для різних атомів одного і того ж елемента. Коли два атоми одного елемента з однаковою кількістю протонів мають різну кількість нейтронів, вони є різними ізотопами цього елемента. На відміну від кількості протонів, яке ніколи не змінюється, число нейтронів в атомах певного елемента може часто змінюватися, тому середня атомна маса елемента записується у вигляді десяткового дробу зі значенням, що лежить між двома сусідніми цілими числами.
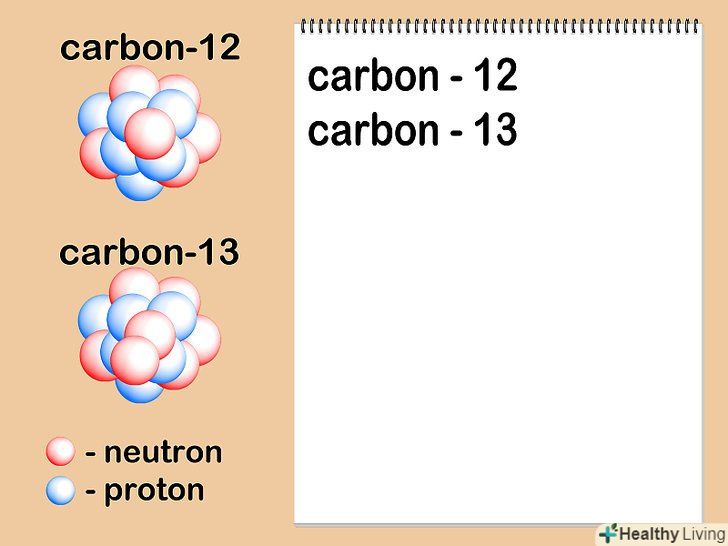
Знайдіть число нейтронів в ядрі.кількість нейтронів може бути різною для різних атомів одного і того ж елемента. Коли два атоми одного елемента з однаковою кількістю протонів мають різну кількість нейтронів, вони є різними ізотопами цього елемента. На відміну від кількості протонів, яке ніколи не змінюється, число нейтронів в атомах певного елемента може часто змінюватися, тому середня атомна маса елемента записується у вигляді десяткового дробу зі значенням, що лежить між двома сусідніми цілими числами.- Кількість нейтронів можна визначити за позначенням ізотопу елемента. Наприклад, вуглець - 14 являє собою радіоактивний ізотоп вуглецю-12, що зустрічається в природі. Часто номер ізотопу вказується у вигляді надрядкового числа, що стоїть перед символом елемента:14C. кількість нейтронів знаходиться шляхом віднімання числа протонів з номера ізотопу: 14-6 = 8 нейтронів.
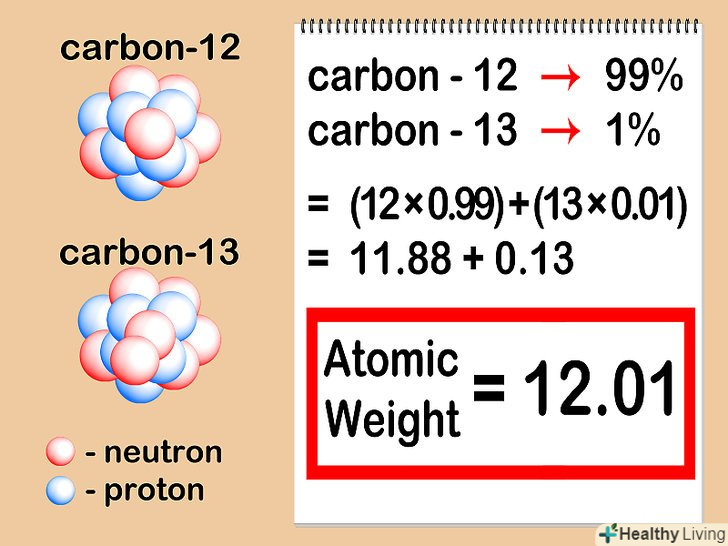
- Припустимо, що цікавить нас атом вуглецю має шість нейтронів (12C). Це найбільш поширений ізотоп вуглецю, що налічує близько 99% всіх атомів даного елемента.[7] однак близько 1% атомів вуглецю мають 7 нейтронів (13C). Інші види атомів вуглецю мають більше 7 або менше 6 нейтронів і існують в дуже малих кількостях.
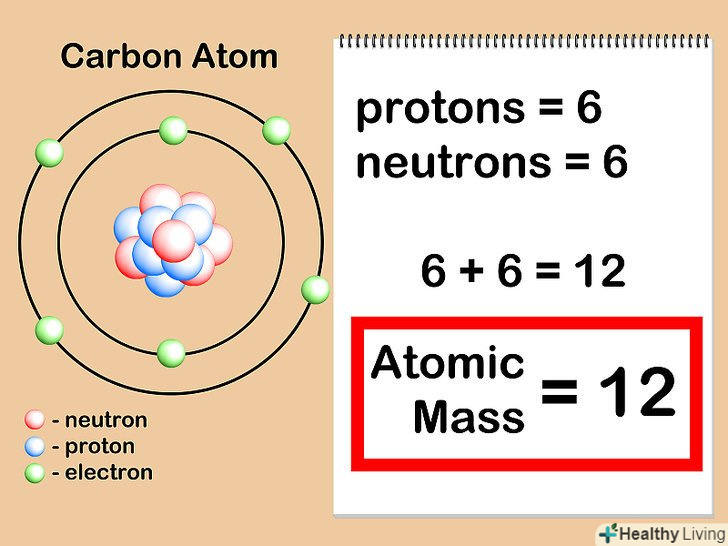
 Складіть кількість протонів і нейтронів.це і буде атомною масою даного атома. Не звертайте уваги на кількість електронів, які оточують ядро - їх сумарна маса надзвичайно мала, тому вони практично не впливають на ваші розрахунки.
Складіть кількість протонів і нейтронів.це і буде атомною масою даного атома. Не звертайте уваги на кількість електронів, які оточують ядро - їх сумарна маса надзвичайно мала, тому вони практично не впливають на ваші розрахунки.- Наш атом вуглецю має 6 протонів + 6 нейтронів = 12. Таким чином, атомна маса даного атома вуглецю дорівнює 12. Якби це був ізотоп "вуглець-13", то ми б знали, що у нього є 6 протонів + 7 нейтронів = атомна маса 13.
- Насправді атомна маса вуглецю - 13 становить 13,003355[8], причому це значення є більш точним, оскільки було визначено експериментальним шляхом.
- Атомна маса дуже близька до номера ізотопу. Для зручності обчислень номер ізотопу часто вважають рівним атомній масі. Експериментально визначені значення атомної маси трохи перевищують номер ізотопу через дуже малий внесок з боку електронів.
Метод3 З 3:
Обчислення відносної атомної маси (атомної ваги елемента
 Визначте, які ізотопи містяться в зразку.хіміки часто визначають співвідношення ізотопів у конкретному зразку за допомогою спеціального приладу під назвою мас-спектрометр. Однак при навчанні ці дані будуть надані вам в умовах завдань, контрольних і так далі у вигляді значень, взятих з наукової літератури.
Визначте, які ізотопи містяться в зразку.хіміки часто визначають співвідношення ізотопів у конкретному зразку за допомогою спеціального приладу під назвою мас-спектрометр. Однак при навчанні ці дані будуть надані вам в умовах завдань, контрольних і так далі у вигляді значень, взятих з наукової літератури.- У нашому випадку припустимо, що ми маємо справу з двома ізотопами: вуглецем-12 і вуглецем-13.
 Визначте відносний вміст кожного ізотопу у зразку.для кожного елемента різні ізотопи зустрічаються в різних співвідношеннях. Ці співвідношення майже завжди виражають у відсотках. Деякі ізотопи зустрічаються дуже часто, тоді як інші дуже рідкісні – часом настільки, що їх насилу можна виявити. Ці величини можна визначити за допомогою мас-спектрометрії або знайти в довіднику.
Визначте відносний вміст кожного ізотопу у зразку.для кожного елемента різні ізотопи зустрічаються в різних співвідношеннях. Ці співвідношення майже завжди виражають у відсотках. Деякі ізотопи зустрічаються дуже часто, тоді як інші дуже рідкісні – часом настільки, що їх насилу можна виявити. Ці величини можна визначити за допомогою мас-спектрометрії або знайти в довіднику.- Припустимо, що концентрація вуглецю-12 дорівнює 99%, а вуглецю – 13-1%. Інші ізотопи вуглецюдійсно існують, але в кількостях настільки малих, що в даному випадку ними можна знехтувати.
 Помножте атомну масу кожного ізотопу на його концентрацію в зразку.помножте атомну масу кожного ізотопу на його процентний вміст (виражене у вигляді десяткового дробу). Щоб перевести відсотки в десятковий дріб, просто розділіть їх на 100. Отримані концентрації в сумі завжди повинні давати 1.
Помножте атомну масу кожного ізотопу на його концентрацію в зразку.помножте атомну масу кожного ізотопу на його процентний вміст (виражене у вигляді десяткового дробу). Щоб перевести відсотки в десятковий дріб, просто розділіть їх на 100. Отримані концентрації в сумі завжди повинні давати 1.- Наш зразок містить вуглець-12 і вуглець-13. Якщо вуглець - 12 становить 99% зразка, а вуглець-13 – 1%, то необхідно помножити 12 (атомна маса вуглецю-12) на 0,99 і 13 (атомна маса вуглецю-13) на 0,01.
- У довідниках даються процентні співвідношення, засновані на відомих кількостях всіх ізотопів того чи іншого елемента. Більшість підручників з хімії містять цю інформацію у вигляді таблиці в кінці книги. Для досліджуваного зразка відносні концентрації ізотопів можна також визначити за допомогою мас-спектрометра.
 Складіть отримані результати.підсумуйте результати множення, які ви отримали в попередньому кроці. В результаті цієї операції ви знайдете відносну атомну масу вашого елемента-середнє значення атомних мас ізотопів розглянутого елемента. Коли розглядається елемент в цілому, а не конкретний ізотоп даного елемента, використовується саме ця величина.
Складіть отримані результати.підсумуйте результати множення, які ви отримали в попередньому кроці. В результаті цієї операції ви знайдете відносну атомну масу вашого елемента-середнє значення атомних мас ізотопів розглянутого елемента. Коли розглядається елемент в цілому, а не конкретний ізотоп даного елемента, використовується саме ця величина.- У нашому прикладі 12 x 0,99 = 11,88 для вуглецю-12, і 13 x 0,01 = 0,13 для вуглецю-13. Відносна атомна маса в нашому випадку становить 11,88 + 0,13 =12,01.
Поради
- Деякі ізотопи менш стабільні, ніж інші: вони розпадаються на атоми елементів з меншою кількістю протонів і нейтронів в ядрі з виділенням частинок, що входять до складу атомного ядра. Такі ізотопи називають радіоактивними.
Що вам знадобиться
- Довідник з хімії
- Калькулятор
Джерела
- ↑ Http://study.com/academy/lesson/what-is-atomic-mass-definition-examples-quiz.html
- ↑ Http://education.jlab.org/qa/particlemass_02.html
- ↑ Http://www.chemteam.info/Mole/AverageAtomicWeight.html
- ↑ Http://sciencenotes.org/calculate-atomic-mass-tutorial/
- ↑ Http://study.com/academy/lesson/what-are-isotopes-definition-types-examples.html
- ↑ Https://www.nde-ed.org/EducationResources/HighSchool/Radiography/atomicmassnumber.htm
- ↑ Http://www.chemteam.info/Mole/AverageAtomicWeight.html
- ↑ Http://www.chemteam.info/Mole/AverageAtomicWeight.html