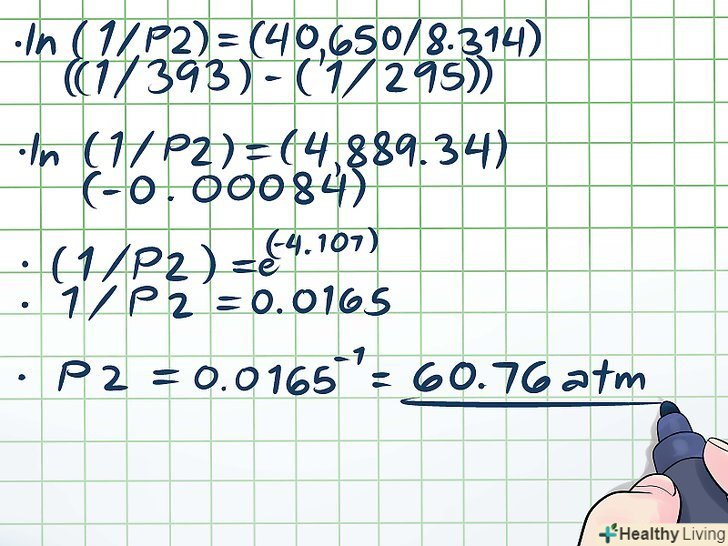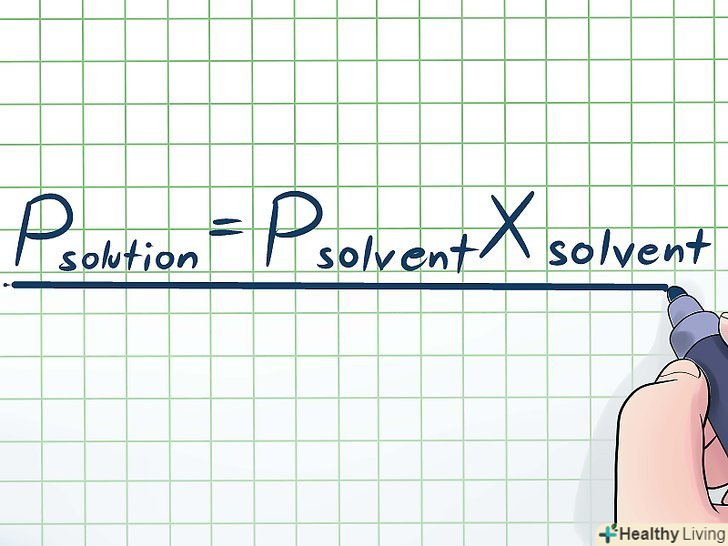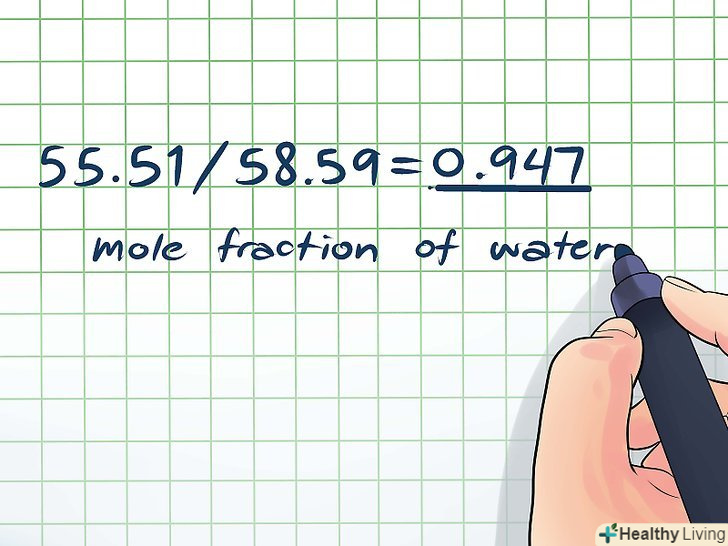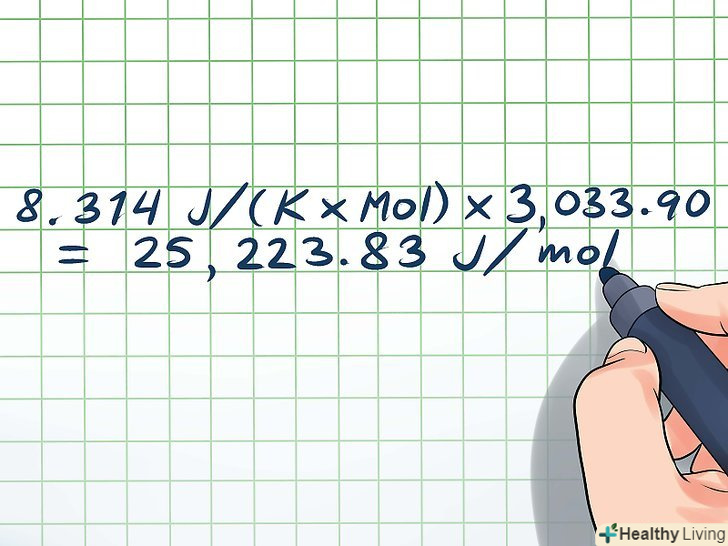Ви коли-небудь залишали пляшку води на кілька годин під палючим сонцем і чули» шиплячий " звук, відкриваючи її? Цей звук викликаний тиском пари. У хімії тиск пари-це тиск, який чиниться парами рідини, яка випаровується в герметично закритій посудині.[1] щоб знайти тиск пари при даній температурі, скористайтеся рівнянням Клапейрона-Клаузіуса: Ln(P1/P2) = (ΔHvap/R)((1/T2) - (1/T1)).
Кроки
Метод1З 3:
Використовуючи рівняння Клапейрона-Клаузіуса
Метод1З 3:
 Запишіть рівняння Клапейрона-Клаузіуса, яке використовується для розрахунку тиску пари при його зміні з плином часу. [2] цю формулу можна використовувати в більшості фізичних і хімічних завдань. Рівняння виглядає наступним чином: Ln(P1/P2) = (ΔHvap/R)((1/T2) - (1/T1)), де:
Запишіть рівняння Клапейрона-Клаузіуса, яке використовується для розрахунку тиску пари при його зміні з плином часу. [2] цю формулу можна використовувати в більшості фізичних і хімічних завдань. Рівняння виглядає наступним чином: Ln(P1/P2) = (ΔHvap/R)((1/T2) - (1/T1)), де:- ΔHvap - ентальпія випаровування рідини. Її, як правило, можна знайти в таблиці в підручниках з хімії.
- R – газова постійна, рівна 8,314 Дж/(k х моль)[3]
- T1-початкова температура (при якій тиск пари відомо).
- T2-кінцева температура (при якій тиск пари невідомий).
- P1 і P2-тиск пари при температурі T1 і T2, відповідно.
 Підставте в рівняння Клапейрона-Клаузіуса дані вам значення величин.у більшості завдань даються два значення температури і значення тиску або два значення тиску і значення температури.
Підставте в рівняння Клапейрона-Клаузіуса дані вам значення величин.у більшості завдань даються два значення температури і значення тиску або два значення тиску і значення температури.- Наприклад, в посудині знаходиться рідина при температурі 295 К, а тиск її парів дорівнює 1 атмосфері (1 атм). Знайдіть тиск парів при температурі 393 K. тут вам дані два значення температури і значення тиску, тому ви можете знайти інше значення тиску за допомогою рівняння Клапейрона-Клаузіуса. Підставивши дані вам значення в формулу, ви отримаєте:Ln(1/P2) = (ΔHvap / R)((1/393) - (1/295)).
- Зверніть увагу, що в рівнянні Клапейрона-Клаузіуса температура завжди вимірюється в кельвінах, а тиск в будь-яких одиницях виміру (але вони повинні бути однаковими для Р1 і Р2).
 Підставте константи. рівняння Клапейрона-Клаузіуса містить дві константи: R і ΔHvap. R завжди дорівнює 8,314 Дж/(К×моль). Значення ΔHvap (ентальпія випаровування) залежить від речовини, тиск парів якого ви намагаєтеся знайти; цю константу, як правило, можна знайти в таблиці в підручниках з хімії або на сайтах (наприклад, здесь).[4]
Підставте константи. рівняння Клапейрона-Клаузіуса містить дві константи: R і ΔHvap. R завжди дорівнює 8,314 Дж/(К×моль). Значення ΔHvap (ентальпія випаровування) залежить від речовини, тиск парів якого ви намагаєтеся знайти; цю константу, як правило, можна знайти в таблиці в підручниках з хімії або на сайтах (наприклад, здесь).[4]- У нашому прикладі припустимо, що в посудині знаходиться вода. ΔHvap води дорівнює 40,65 кДж/моль або дорівнює 40650 Дж / моль.
- Підставте константи в формулу і отримаєте: ln (1 / P2) = (40650/8314)((1/393) - (1/295)).
 Вирішіть рівняння за допомогою алгебраїчних операцій.
Вирішіть рівняння за допомогою алгебраїчних операцій.- У нашому прикладі невідома змінна знаходиться під знаком натурального логарифма (ln). Для позбавлення від натурального логарифму Перетворіть обидві сторони рівняння в ступінь математичної константи "е". Іншими словами,Ln(x) = 2 → e ln(x) = e 2 → x = e2.
- Тепер вирішіть рівняння:
- Ln(1/P2) = (40650/8,314)((1/393) - (1/295))
- Ln(1/P2) = (4889,34)(-0,00084)
- (1/P2) = e(-4,107)
- 1/P2 = 0,0165
- P2 = 0.0165 -1 = 60,76 атм.це має сенс, так як підвищення температури в герметично закритій посудині на 100 градусів призведе до збільшення пароутворення, що значно збільшить тиск пари.
Метод2 З 3:
Обчислення тиску пари в розчинах
Метод2 З 3:
 Запишіть закон Рауля.у реальному житті чисті рідини зустрічаються рідко; найчастіше ми маємо справу з розчинами. Розчин виходить при додаванні невеликої кількості певної хімічної речовини, званого "розчинена речовина«, в більшу кількість іншої хімічної речовини, званого»розчинник". У випадках розчинів користуйтеся законом Рауля:[5]Pрозчин = Pрозчинник X розчинник , де:
Запишіть закон Рауля.у реальному житті чисті рідини зустрічаються рідко; найчастіше ми маємо справу з розчинами. Розчин виходить при додаванні невеликої кількості певної хімічної речовини, званого "розчинена речовина«, в більшу кількість іншої хімічної речовини, званого»розчинник". У випадках розчинів користуйтеся законом Рауля:[5]Pрозчин = Pрозчинник X розчинник , де:- Pрозчин - тиск парів розчину.
- Pрозчинник – тиск парів розчинника.
- Xрозчинник - мольна частка розчинника.
- Якщо ви не знаєте, що таке «мольна частка», читайте далі.
 Визначте, яка речовина буде розчинником, а яка-розчиненою речовиною.нагадаємо, що розчинена речовина-це речовина, що розчиняється в розчиннику, а розчинник – це речовина, що розчиняє розчинену речовину.
Визначте, яка речовина буде розчинником, а яка-розчиненою речовиною.нагадаємо, що розчинена речовина-це речовина, що розчиняється в розчиннику, а розчинник – це речовина, що розчиняє розчинену речовину.- Розглянемо приклад сиропу. Для отримання сиропу одну частину цукру розчиняють в одній частині води, тому цукор – це розчинена речовина, а вода – це розчинник.[6]
- Зверніть увагу, що хімічна формула сахарози( звичайного цукру): c12H22O11. Вона знадобиться нам надалі.
 Знайдіть температуру розчину, так як вона буде впливати на тиск його пари.чим вище температура, тим вище тиск парів, так як з ростом температури зростає пароутворення.
Знайдіть температуру розчину, так як вона буде впливати на тиск його пари.чим вище температура, тим вище тиск парів, так як з ростом температури зростає пароутворення.- У нашому прикладі припустимо, що температура сиропу дорівнює 298 K (близько 25С).
 Знайдіть тиск парів розчинника.у довідниках з хімії наводяться значення тиску парів багатьох поширених хімічних речовин, але, як правило, такі значення дані при температурі речовин в 25°С/298 К або при їх температурах кипіння. Якщо в задачі вам дані такі температури, використовуйте значення з довідників; в іншому випадку вам необхідно обчислити тиск парів при даній температурі речовини.
Знайдіть тиск парів розчинника.у довідниках з хімії наводяться значення тиску парів багатьох поширених хімічних речовин, але, як правило, такі значення дані при температурі речовин в 25°С/298 К або при їх температурах кипіння. Якщо в задачі вам дані такі температури, використовуйте значення з довідників; в іншому випадку вам необхідно обчислити тиск парів при даній температурі речовини.- Для цього скористайтеся рівнянням Клапейрона-Клаузіуса, підставивши в нього тиск парів і температуру 298 К (25С) замість P1 і T1, відповідно.
- У нашому прикладі температура розчину дорівнює 25°С, тому користуйтеся значенням з довідкових таблиць – тиск парів води при 25°С дорівнює 23,8 мм ртутного стовпа.[7]
 Знайдіть мольну частку розчинника.для цього знайдіть відношення числа молей речовини до загального числа молей всіх речовин, наявних в розчині. Іншими словами, мольна частка кожної речовини дорівнює (число молей речовини)/(загальне число молей всіх речовин).
Знайдіть мольну частку розчинника.для цього знайдіть відношення числа молей речовини до загального числа молей всіх речовин, наявних в розчині. Іншими словами, мольна частка кожної речовини дорівнює (число молей речовини)/(загальне число молей всіх речовин).- Припустимо, що для приготування сиропу ви використовували 1 л води і 1 л сахарози (цукру). В цьому випадку необхідно знайти число молей кожної речовини. Для цього потрібно знайти масу кожної речовини, а потім використовувати молярні маси цих речовин, щоб отримати молі.
- Маса 1 л води = 1000 г
- Маса 1 л цукру = 1056,7 г[8]
- Моль (вода): 1000 г х 1 моль / 18,015 г = 55,51 моль
- Моль (сахароза): 1056,7 г x 1 моль/342,2965 г = 3,08 моль (зверніть увагу, що ви можетезнайти молярну масу сахарози з її хімічної формули c12H22O11).
- Загальне число молей: 55,51 + 3,08 = 58,59 моль
- Мольна частка води: 55,51 / 58,59 = 0,947.
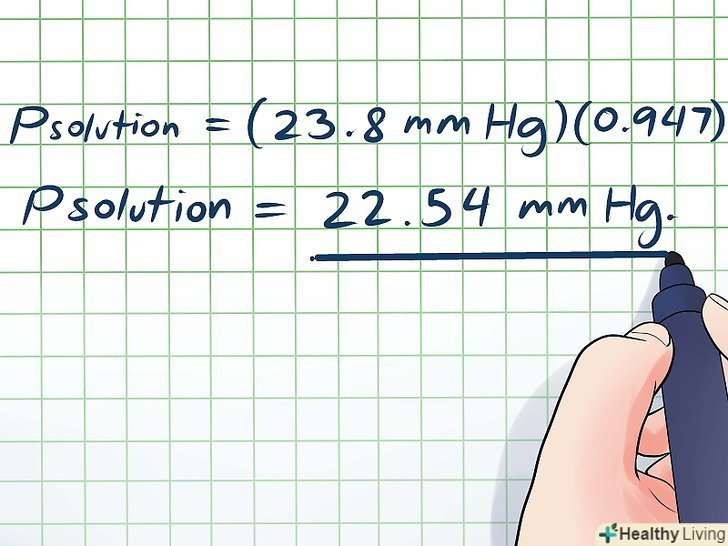
 Тепер підставте дані і знайдені значення величин в рівняння Рауля, наведене на початку цього розділу (Pрозчин = PрозчинникXрозчинник ).
Тепер підставте дані і знайдені значення величин в рівняння Рауля, наведене на початку цього розділу (Pрозчин = PрозчинникXрозчинник ).- У нашому прикладі:
- Pрозчин = (23,8 мм рт. ст.) (0,947)
- Pрозчин = 22,54 мм рт. це має сенс, так як у великій кількості води розчинено невелику кількість цукру (якщо вимірювати в молях; в літрах їх кількість однаково), тому тиск парів незначно зменшиться.
Метод3 З 3:
Обчислення тиску пари в особливих випадках
Метод3 З 3:
 Визначення стандартних умов.найчастіше в хімії використовуються значення температури і тиску як свого роду значення «за замовчуванням». Такі значення називаються стандартними температурою і тиском (або стандартними умовами). У завданнях на тиск пари часто згадуються стандартні умови, тому краще запам'ятати стандартні значення:[9]
Визначення стандартних умов.найчастіше в хімії використовуються значення температури і тиску як свого роду значення «за замовчуванням». Такі значення називаються стандартними температурою і тиском (або стандартними умовами). У завданнях на тиск пари часто згадуються стандартні умови, тому краще запам'ятати стандартні значення:[9]- Температура: 273,15 K / 0C / 32 F
- Тиск: 760 мм рт.СТ./1 атм./ 101,325 кПа
 Перепишіть рівняння Клапейрона-Клаузіуса так, щоб знайти інші змінні.у першому розділі цієї статті було показано, як обчислювати тиску парів чистих речовин. Однак не у всіх завданнях потрібно знайти тиск P1 або P2; у багатьох завданнях потрібно обчислити температуру або значення ΔHvap. У таких випадках перепишіть рівняння Клапейрона-Клаузіуса, відокремивши невідому величину на одній стороні рівняння.
Перепишіть рівняння Клапейрона-Клаузіуса так, щоб знайти інші змінні.у першому розділі цієї статті було показано, як обчислювати тиску парів чистих речовин. Однак не у всіх завданнях потрібно знайти тиск P1 або P2; у багатьох завданнях потрібно обчислити температуру або значення ΔHvap. У таких випадках перепишіть рівняння Клапейрона-Клаузіуса, відокремивши невідому величину на одній стороні рівняння.- Наприклад, дана невідома рідина, тиск пари якої дорівнює 25 торр при 273 К і 150 Торр при 325 к.потрібно знайти ентальпію випаровування цієї рідини (тобто ΔHvap). Вирішення цього завдання:
- Ln(P1/P2) = (ΔHvap/R)((1/T2) - (1/T1))
- (ln(P1/P2))/((1/T2) - (1/T1)) = (ΔHvap/R)
- R × (ln(P1/P2))/((1/T2) - (1/T1)) = ΔHvap Тепер підставте дані вам значення:
- 8,314 Дж/(K × моль) × (-1,79)/(-0,00059) = ΔHvap
- 8,314 Дж/(K × моль) × 3033,90 = ΔHvap = 25223,83 Дж/моль
 Врахуйте тиску пари розчиненої речовини. у нашому прикладі з другого розділу цієї статті розчинена речовина-цукор - не випаровується, але якщо розчинена речовина виробляє пар (випаровується), тиск такої пари слід врахувати. Для цього скористайтеся модифікованим видом рівняння Рауля: Pрозчин = Σ (PречовинаX речовина), де символ Σ (сигма) означає, що необхідно скласти значення тисків парів всіх речовин, з яких складається розчин.
Врахуйте тиску пари розчиненої речовини. у нашому прикладі з другого розділу цієї статті розчинена речовина-цукор - не випаровується, але якщо розчинена речовина виробляє пар (випаровується), тиск такої пари слід врахувати. Для цього скористайтеся модифікованим видом рівняння Рауля: Pрозчин = Σ (PречовинаX речовина), де символ Σ (сигма) означає, що необхідно скласти значення тисків парів всіх речовин, з яких складається розчин.- Наприклад, розглянемо розчин, що складається з двох хімічних речовин: бензолу і толуолу. Загальний обсяг розчину 120 мілілітрів( мл); 60 мл бензолу і 60 мл толуолу. Температура розчину дорівнює 25°С, а тиск парів при 25°С дорівнює 95,1 мм рт.СТ. для бензолу і 28,4 мм рт.СТ. для толуолу. Необхідно обчислити тиск парів розчину. Ми можемо зробити це за допомогою щільності речовин, їх молекулярних мас і значень тиску парів:
- Маса (бензол): 60 мл = 0,06 л x 876,50 кг/1000 л = 0,053 кг = 53 г
- Маса (толуол): 0,06 л × 866,90 кг/1000 л = 0,052 кг = 52 г
- Моль (бензол): 53 г х 1 моль / 78,11 г = 0,679 моль
- Моль (толуол): 52 г х 1 моль / 92,14 г = 0,564 моль
- Загальне число молей: 0,679 + 0,564 = 1,243
- Мольна частка (бензол): 0,679/1,243 = 0,546
- Мольна частка (толуол): 0,564/1,243 = 0,454
- Рішення: Pрозчин = PбензолXбензол + PтолуолXтолуол
- Pрозчин = (95,1 мм рт. ст.) (0,546) + (28,4 мм рт. ст.) (0,454)
- Pрозчин = 51,92 мм рт. ст. + 12,89 мм рт. ст. = 64,81 мм рт. ст.
Поради
- Для використання рівняння Клапейрона Клаузіуса температура повинна бути вказана в градусах Кельвіна (позначається К). Якщо у вас дана температура за Цельсієм, необхідно конвертувати її за допомогою наступної формули:Tk = 273 + Tc
- Описаний вище метод працює, тому що енергія прямо пропорційна кількості тепла. Температура рідини є єдиним фактором навколишнього середовища, від якої залежить тиск парів.
Джерела
- ↑ Https://www.chem.purdue.edu/gchelp/liquids/vpress.html
- ↑ Http://bado-shanai.net/Map%20of%20Physics/mopClausiusClapeyron.htm
- ↑ Http://www.chem.umass.edu/~thompson/Courses/chem471/old.exams/2010/formulae4.pdf
- ↑ Http://www.phs.d211.org/science/smithcw/AP%20Chemistry/Posted%20Tables/Enthalpy%20Vaporization%20and%20Fusion.pdf
- ↑ Http://chemwiki.ucdavis.edu/Physical_Chemistry/Physical_Properties_of_Matter/Solutions_and_Mixtures/Ideal_Solutions/Changes_In_Vapor_Pressure,_Raoult%27s_Law
- ↑ Http://allrecipes.com/recipe/simple-syrup/
- ↑ Http://intro.chem.okstate.edu/1515sp01/database/vpwater.html
- ↑ Http://www.traditionaloven.com/culinary-arts/sugars/raw-sugar/convert-liter-l-to-gram-g-raw-sugar.html
- ↑ Http://whatis.techtarget.com/definition/standard-temperature-and-pressure-STP