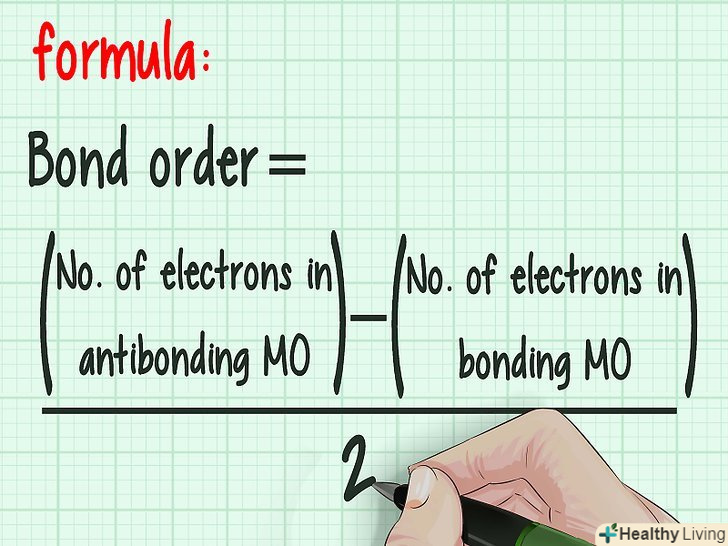
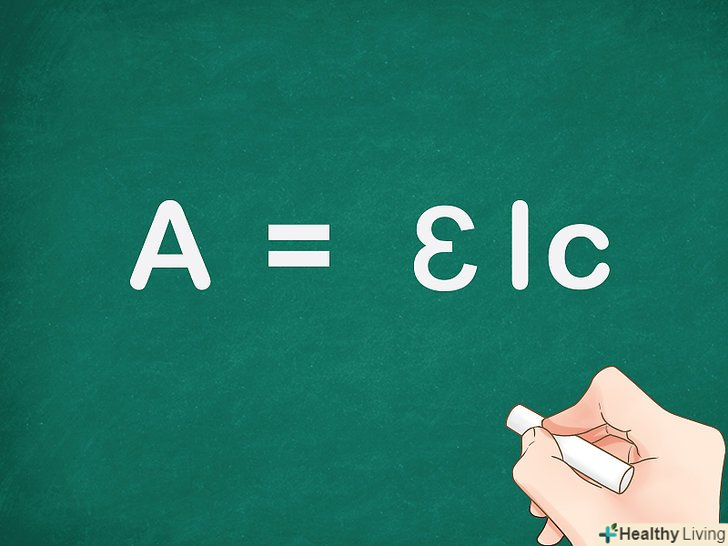На атомному рівні кратністю зв'язку називається число пар пов'язаних електронів між двома атомами. Наприклад, у двоатомному азоті (N≡N) кратність зв'язку дорівнює трьом, оскільки два атоми азоту з'єднані трьома хімічними зв'язками. У теорії молекулярних орбіталей кратність зв'язку визначається як половина різниці між кількістю зв'язуючих і розпушують електронів. Таким чином, кратність зв'язку можна розрахувати за такою формулою :Кратність зв'язку = [(Число електронів на зв'язуючих орбіталях – - (Число електронів на розпушують орбіталях)] / 2.[1]
Кроки
Метод1З 3:
Як швидко знайти кратність зв'язку
Метод1З 3:
 Запам'ятайте формулу. в теорії молекулярних орбіталей кратність зв'язку визначається як половина різниці між кількістю зв'язуючих і розпушують електронів:Кратність зв'язку = [(Число електронів на зв'язуючих орбіталях) – (Число електронів на розпушують орбіталях)]/2.
Запам'ятайте формулу. в теорії молекулярних орбіталей кратність зв'язку визначається як половина різниці між кількістю зв'язуючих і розпушують електронів:Кратність зв'язку = [(Число електронів на зв'язуючих орбіталях) – (Число електронів на розпушують орбіталях)]/2. Чим більше кратність зв'язку, тим стабільніше молекула.кожен електрон, який потрапив на зв'язуючу орбіталь, стабілізує нову молекулу. І навпаки, що знаходяться на розпушують орбіталях електрони дестабілізують молекулу. Кратність зв'язку визначає енергетичний рівень утвореної молекули.
Чим більше кратність зв'язку, тим стабільніше молекула.кожен електрон, який потрапив на зв'язуючу орбіталь, стабілізує нову молекулу. І навпаки, що знаходяться на розпушують орбіталях електрони дестабілізують молекулу. Кратність зв'язку визначає енергетичний рівень утвореної молекули.- Якщо кратність зв'язку дорівнює нулю, молекула не може утворитися. Чим вище кратність зв'язку, тим стабільніша молекула.
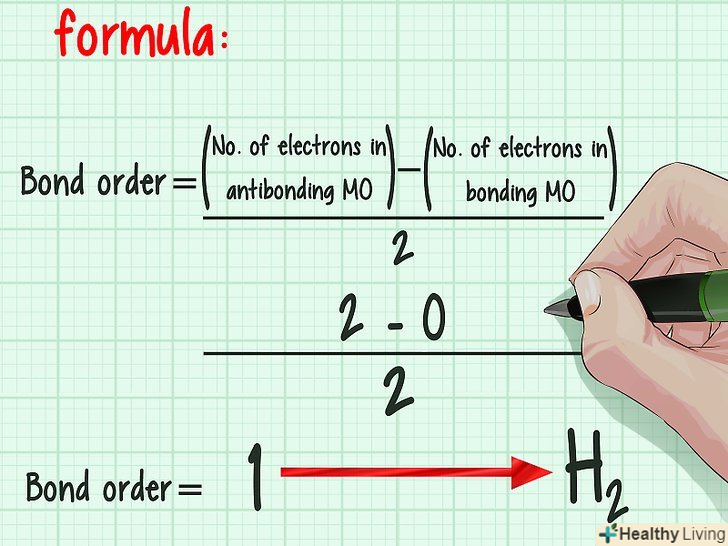
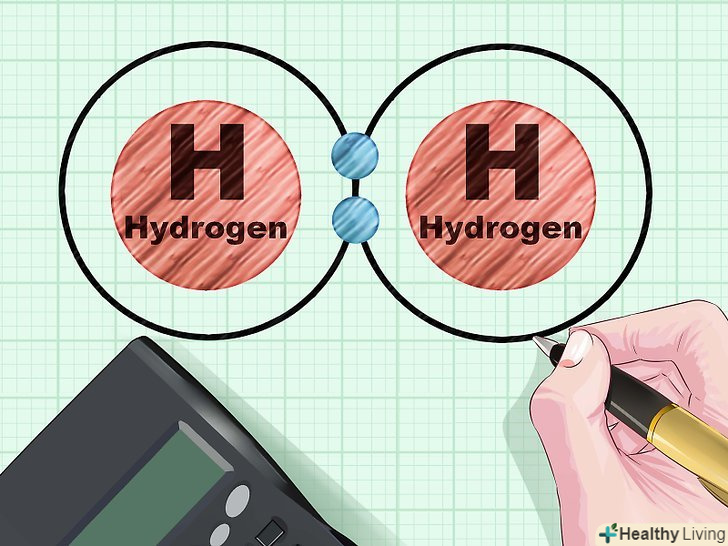
 Розглянемо простий приклад.атоми водню мають один електрон наs -оболонці, яка здатна вмістити два електрона. Коли з'єднуються два атома водню, s-оболонка кожного доповнюється другим електроном. В результаті утворюються дві зв'язують орбіталі. Електронам не доводиться переходити на більш високу p-оболонку, тому не утворюється розпушують орбіталей. Таким чином, кратність зв'язку становить
Розглянемо простий приклад.атоми водню мають один електрон наs -оболонці, яка здатна вмістити два електрона. Коли з'єднуються два атома водню, s-оболонка кожного доповнюється другим електроном. В результаті утворюються дві зв'язують орбіталі. Електронам не доводиться переходити на більш високу p-оболонку, тому не утворюється розпушують орбіталей. Таким чином, кратність зв'язку становить, тобто 1. В результаті утворюється звичайна молекула газоподібного водню H2.
Метод2 З 3:
Як зобразити кратність хімічного зв'язку
Метод2 З 3:
 Навчіться швидко визначати кратність зв'язку. у разі простої ковалентного зв'язку кратність дорівнює одному; при подвійній ковалентного зв'язку кратність дорівнює двом; для потрійної ковалентного зв'язку кратність дорівнює трьом, і так далі.[2] просто кажучи, кратність зв'язку-це число пар пов'язаних електронів, які утримують два атоми разом.
Навчіться швидко визначати кратність зв'язку. у разі простої ковалентного зв'язку кратність дорівнює одному; при подвійній ковалентного зв'язку кратність дорівнює двом; для потрійної ковалентного зв'язку кратність дорівнює трьом, і так далі.[2] просто кажучи, кратність зв'язку-це число пар пов'язаних електронів, які утримують два атоми разом. Дізнайтеся, як атоми з'єднуються в молекули.у будь-якій молекулі складові її атоми з'єднані зв'язуючими парами електронів. Ці електрони обертаються навколо ядра атома по "орбиталям". Наприклад, кожнаS -оболонка може вміщати не більше двох електронів. Якщо така оболонка "не заповнена", то на ній немає електронів або вона містить лише один електрон. У цьому випадку незв'язаний електрон може з'єднатися з відповідним одиночним електроном іншого атома.
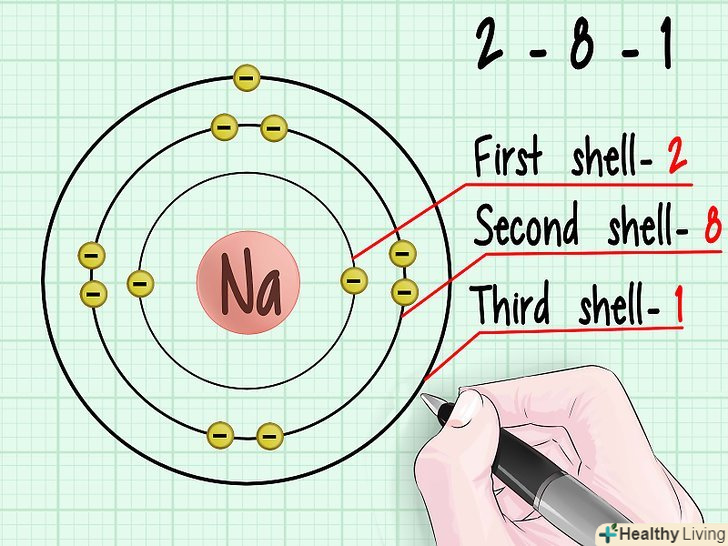
Дізнайтеся, як атоми з'єднуються в молекули.у будь-якій молекулі складові її атоми з'єднані зв'язуючими парами електронів. Ці електрони обертаються навколо ядра атома по "орбиталям". Наприклад, кожнаS -оболонка може вміщати не більше двох електронів. Якщо така оболонка "не заповнена", то на ній немає електронів або вона містить лише один електрон. У цьому випадку незв'язаний електрон може з'єднатися з відповідним одиночним електроном іншого атома.- Залежно від розмірів і складності конкретного атома, він може мати одну або кілька, аж до чотирьох оболонок.
- Коли заповнюється найближча до ядра електронна оболонка, нові електрони починають заповнювати наступну. Поступово електрони заповнюють наступні оболонки, тому чим більше атом, тим більше електронів він містить.[3]
 Зобразіть точкові структури Льюїса .це зручний спосіб візуально уявити, як атоми з'єднані один з одним в молекулі. Позначте атоми їх хімічними символами (наприклад, H для водню і Cl для хлору). Намалюйте зв'язку між атомами у вигляді ліній, наприклад – для одинарної, = для подвійної і ≡ для потрійного зв'язку. Позначте незв'язані електрони і електронні пари у вигляді точок (наприклад, :C:).[4] після того як ви зобразите точкові структури Льюїса, порахуйте число зв'язків — це і буде кратністю зв'язку.
Зобразіть точкові структури Льюїса .це зручний спосіб візуально уявити, як атоми з'єднані один з одним в молекулі. Позначте атоми їх хімічними символами (наприклад, H для водню і Cl для хлору). Намалюйте зв'язку між атомами у вигляді ліній, наприклад – для одинарної, = для подвійної і ≡ для потрійного зв'язку. Позначте незв'язані електрони і електронні пари у вигляді точок (наприклад, :C:).[4] після того як ви зобразите точкові структури Льюїса, порахуйте число зв'язків — це і буде кратністю зв'язку.- Для двоатомної молекули азоту точкова структура Льюїса матиме вигляд N≡N. кожен атом азоту має одну електронну пару і три незв'язаних електрона. При з'єднанні двох атомів азоту їх шість незв'язаних електронів утворюють сильну потрійну ковалентний зв'язок.[5]
Метод3 З 3:
Як розрахувати кратність зв'язку в теорії молекулярних орбіталей
Метод3 З 3:
 Подивіться на діаграму електронних оболонок атомів. відзначте, що кожна наступна оболонка розташована все далі і далі від атомного ядра. Згідно з властивостями ентропії, будь-яка система прагне до стану з мінімальною можливою енергією. Таким чином, електрони прагнуть зайняти найнижчу оболонку, якщо там є вільні місця.
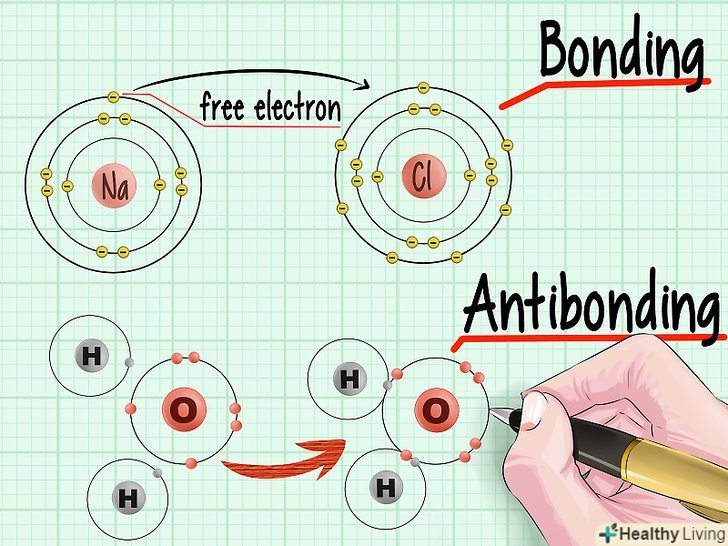
Подивіться на діаграму електронних оболонок атомів. відзначте, що кожна наступна оболонка розташована все далі і далі від атомного ядра. Згідно з властивостями ентропії, будь-яка система прагне до стану з мінімальною можливою енергією. Таким чином, електрони прагнуть зайняти найнижчу оболонку, якщо там є вільні місця. Дізнайтеся про різницю між орбіталями, що зв'язують і розпушують.коли два атоми об'єднуються в молекулу, їх електрони прагнуть заповнити найнижчі рівні в електронних оболонках. При цьому зв'язують електрони об'єднуються один з одним і заповнюють Нижні енергетичні стани. Розпушуючі електрони залишаються "вільними", або незв'язаними, і витісняються на більш високі орбітальні рівні.[6]
Дізнайтеся про різницю між орбіталями, що зв'язують і розпушують.коли два атоми об'єднуються в молекулу, їх електрони прагнуть заповнити найнижчі рівні в електронних оболонках. При цьому зв'язують електрони об'єднуються один з одним і заповнюють Нижні енергетичні стани. Розпушуючі електрони залишаються "вільними", або незв'язаними, і витісняються на більш високі орбітальні рівні.[6]- Зв'язуючі електрони. Якщо ви подивитеся, наскільки заповнені електронні оболонки кожного атома, то зможете визначити, скільки електронів зможуть перейти на більш стабільні оболонки з низькою енергією. Ці "заповнюючі електрони" називають зв'язуючими електронами.
- Розпушуючі електрони. Коли два атоми обмінюються електронами і утворюють молекулу, орбіталі з низькою енергією можуть заповнитися, і в цьому випадку деякі електрони перейдуть на рівні з більш високою енергією. Такі електрони називають розпушують електронами.[7]
Джерела
- ↑ Https://www.boundless.com/chemistry/textbooks/boundless-chemistry-textbook/advanced-concepts-of-chemical-bonding-10/molecular-orbital-theory-82/bond-order-366-591/
- ↑ Http://chemwiki.ucdavis.edu/Theoretical_Chemistry/Chemical_Bonding/General_Principles_of_Chemical_Bonding/Bond_Order_and_Lengths
- ↑ Http://chemistry.tutorvista.com/organic-chemistry/bond-order.html
- ↑ Http://www.chem.ucla.edu/harding/lewisdots.html
- ↑ Http://chemistry.stackexchange.com/questions/27588/how-to-determine-the-bond-order-using-the-lewis-structure
- ↑ Http://www.chemguide.co.uk/atoms/properties/atomorbs.html
- ↑ Http://chemed.chem.purdue.edu/genchem/topicreview/bp/ch8/mo.html