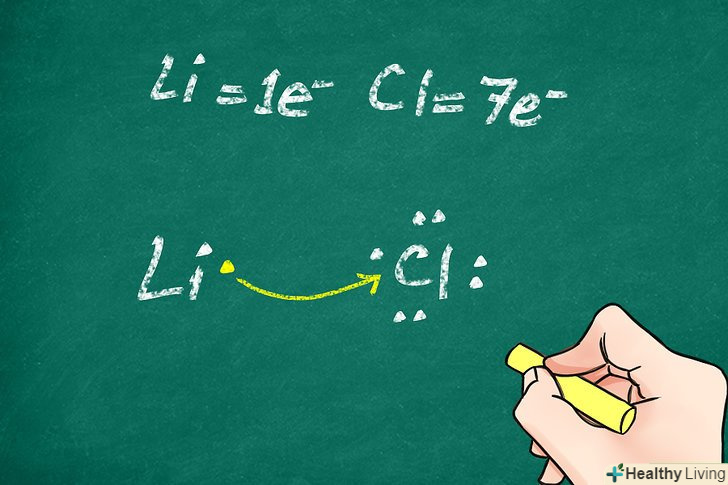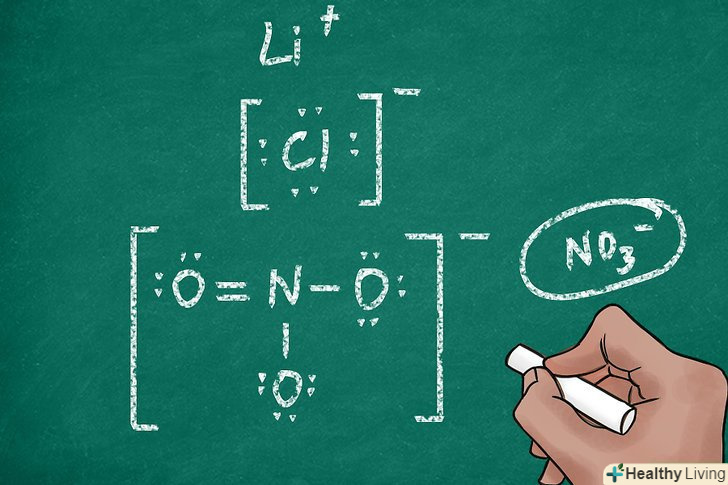Зображення точкових структур Льюїса (також відомих як структури Льюїса або діаграми Льюїса) може здатися складним завданням, особливо для тих, хто тільки починає вивчати хімію. Однак ці структури допомагають зрозуміти конфігурацію зв'язків і валентних електронів в різних атомах і молекулах. Складність схеми залежить від того, чи зображуєте ви точкову структуру Льюїса для двоатомної ковалентної молекули, більш складної ковалентної молекули або молекул з іонним зв'язком.
Кроки
Метод1З 3:
Двоатомні ковалентні молекули
Метод1З 3:
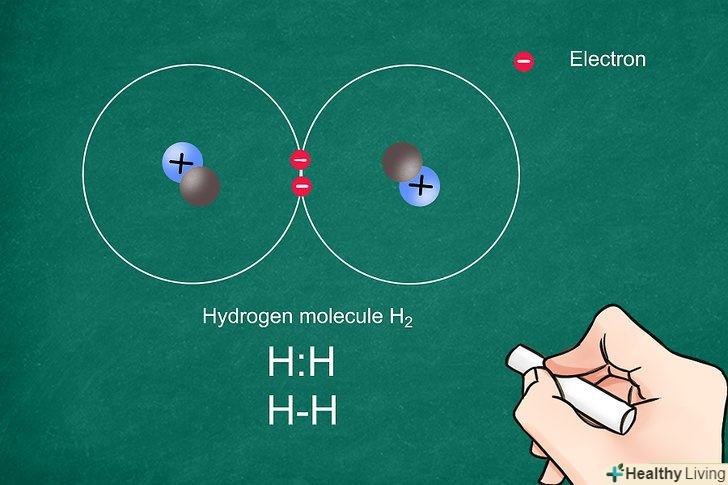
 Запишіть символ кожного елемента. Напишіть поруч символи двох атомів. Таким чином ви представите атоми, з'єднані ковалентним зв'язком. Залиште достатньо місця між символами, щоб позначити електрони та зв'язки.[1]
Запишіть символ кожного елемента. Напишіть поруч символи двох атомів. Таким чином ви представите атоми, з'єднані ковалентним зв'язком. Залиште достатньо місця між символами, щоб позначити електрони та зв'язки.[1]- При ковалентному зв'язку електрони діляться між двома атомами. Зазвичай ковалентні зв'язки виникають між двома неметалічними елементами.
 Визначте кратність зв'язку між двома атомами.атоми можуть бути пов'язані одинарної, подвійний або потрійний зв'язком. Зазвичай це визначається правилом октетів, або» прагненням " кожного атома заповнити свою валентну оболонку 8 електронами (а в разі водню — 2 електронами). Щоб знайти, скільки електронів буде мати кожен атом, визначте кількість валентних електронів в молекулі, а потім помножте його на 2 (кожна зв'язок включає 2 електрона) і додайте число неподілених електронів.[2]
Визначте кратність зв'язку між двома атомами.атоми можуть бути пов'язані одинарної, подвійний або потрійний зв'язком. Зазвичай це визначається правилом октетів, або» прагненням " кожного атома заповнити свою валентну оболонку 8 електронами (а в разі водню — 2 електронами). Щоб знайти, скільки електронів буде мати кожен атом, визначте кількість валентних електронів в молекулі, а потім помножте його на 2 (кожна зв'язок включає 2 електрона) і додайте число неподілених електронів.[2]- Наприклад, O2 (газоподібний кисень) має 6 валентних електронів. Помножимо 6 на 2 і отримаємо 12.
- Щоб визначити, чи дотримано правило октету, використовуйте точки для представлення валентних електронів навколо кожного атома. У випадку O2 один атом кисню має 8 електронів (таким чином, правило октету дотримано), а другий — тільки 6 (тобто правило октету не виконується). Це означає, що між двома атомами кисню потрібно більше одного зв'язку. Отже, для подвійного зв'язку між атомами необхідно два електрона, щоб правило октету виконувалося для обох атомів.
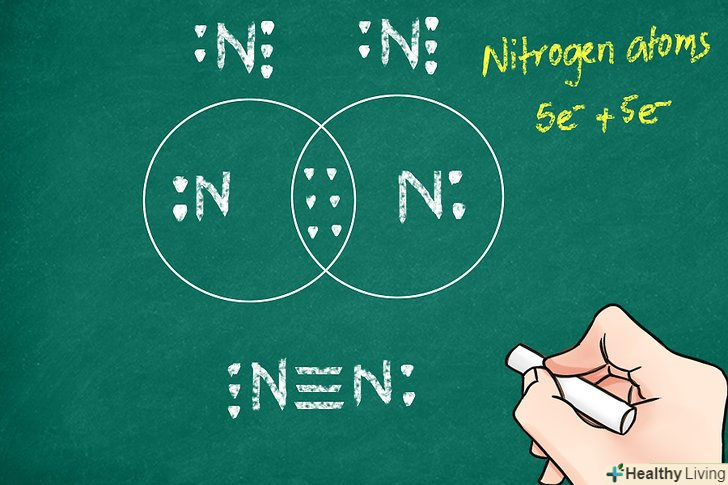
 Намалюйте зв'язки.кожна зв'язок зображується лінією між двома атомами. Для одинарної зв'язку потрібно просто з'єднати лінією два атома. У разі подвійного або потрійного зв'язку необхідно провести відповідно дві або три лінії.[3]
Намалюйте зв'язки.кожна зв'язок зображується лінією між двома атомами. Для одинарної зв'язку потрібно просто з'єднати лінією два атома. У разі подвійного або потрійного зв'язку необхідно провести відповідно дві або три лінії.[3]- Наприклад, в N2 (газоподібному азоті) два атоми пов'язані потрійним зв'язком. Таким чином, на діаграмі Льюїса ця молекула буде зображена як 3 паралельні лінії, що з'єднують 2 атома N.
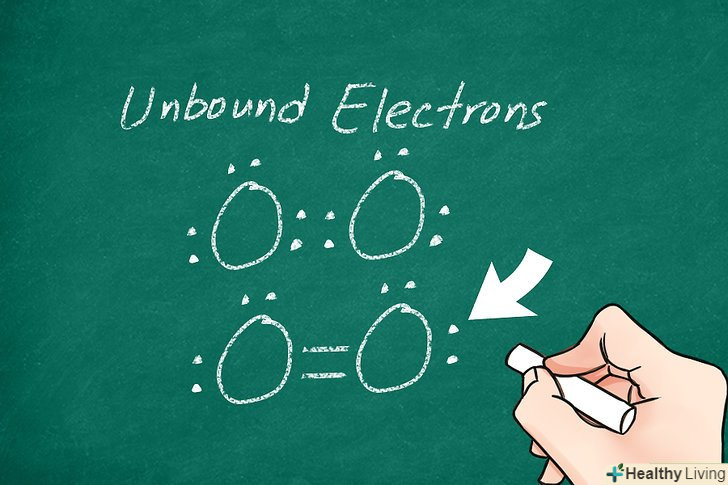
 Позначте незв'язані електрони.деякі електрони одного або обох атомів можуть залишитися незв'язаними. У цьому випадку їх слід позначити точками навколо відповідних атомів. Як правило, атоми не мають більше 8 вільних електронів. Перевірте результат: порахуйте кожну точку як 1 електрон і кожну лінію як 2 електрона.[4]
Позначте незв'язані електрони.деякі електрони одного або обох атомів можуть залишитися незв'язаними. У цьому випадку їх слід позначити точками навколо відповідних атомів. Як правило, атоми не мають більше 8 вільних електронів. Перевірте результат: порахуйте кожну точку як 1 електрон і кожну лінію як 2 електрона.[4]- Наприклад, в O2 (газоподібному кисні) атоми з'єднані двома паралельними лініями, і біля кожного атома стоять дві пари точок, які позначають вільні електрони.
Метод2 З 3:
Ковалентні молекули, що складаються з трьох або більше атомів
Метод2 З 3:
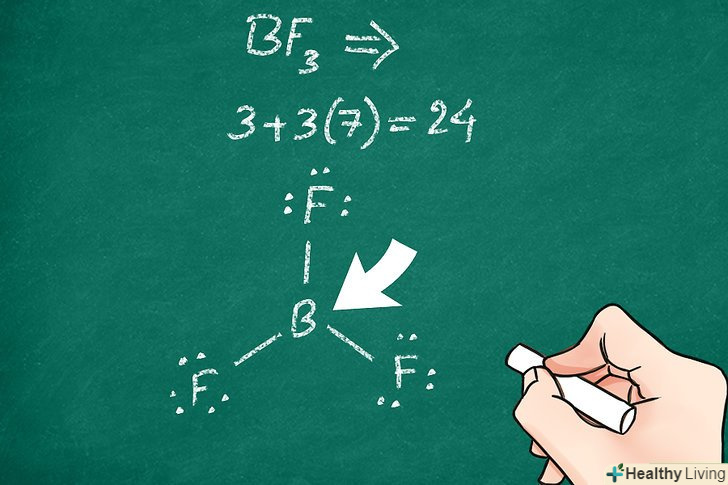
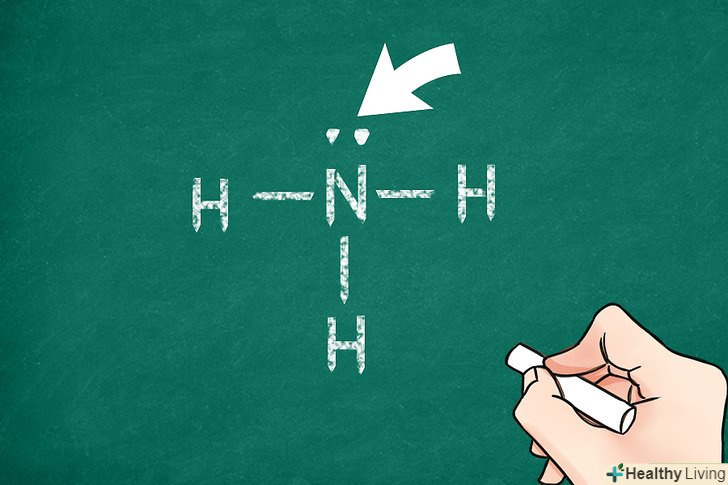
 Визначте, який з атомів є центральним.зазвичай цей атом є найменш електронегативним. Завдяки цьому він найбільш здатний утворювати зв'язки з іншими атомами. Термін "центральний атом" означає, що всі інші атоми в молекулі пов'язані саме з цим атомом (але необов'язково один з одним).[5]
Визначте, який з атомів є центральним.зазвичай цей атом є найменш електронегативним. Завдяки цьому він найбільш здатний утворювати зв'язки з іншими атомами. Термін "центральний атом" означає, що всі інші атоми в молекулі пов'язані саме з цим атомом (але необов'язково один з одним).[5]- В якості центральних атомів часто виступають атоми фосфору і вуглецю.
- У деяких більш складних молекулах може бути кілька центральних атомів.
- Врахуйте, що в таблиці Менделєєва електронегативність збільшується зліва направо і зменшується зверху вниз.
 Перевірте, скільки валентних електронів має центральний атом.зазвичай (але не завжди) атоми прагнуть оточити себе 8 валентними електронами (правило октету). При з'єднанні центрального атома з іншими атомами конфігурація з мінімальною енергією в більшості випадків відповідає октету. Це допоможе вам визначити кількість зв'язків між центральним атомом та іншими атомами, оскільки кожен зв'язок здійснюється двома електронами.[6]
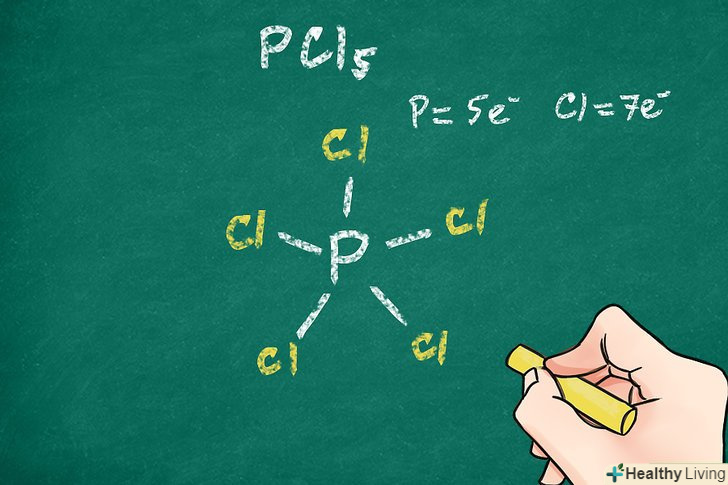
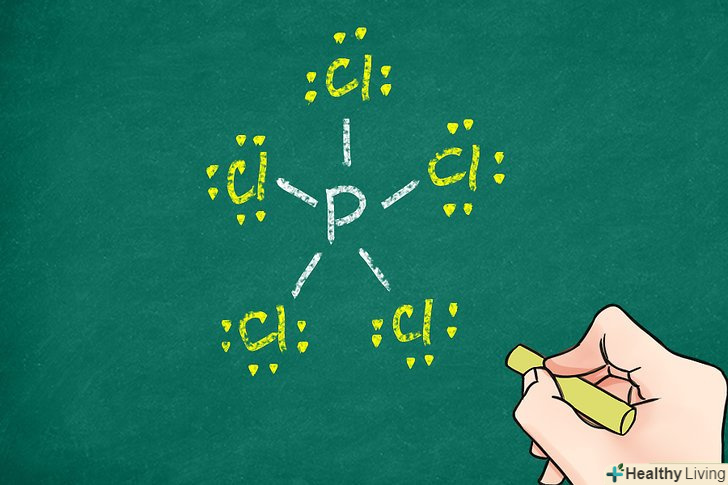
Перевірте, скільки валентних електронів має центральний атом.зазвичай (але не завжди) атоми прагнуть оточити себе 8 валентними електронами (правило октету). При з'єднанні центрального атома з іншими атомами конфігурація з мінімальною енергією в більшості випадків відповідає октету. Це допоможе вам визначити кількість зв'язків між центральним атомом та іншими атомами, оскільки кожен зв'язок здійснюється двома електронами.[6]- Для деяких великих атомів, наприклад атомів фосфору, правило октету може порушуватися.
- Наприклад, в молекулі діоксиду вуглецю (CO2) два атоми кисню ковалентно пов'язані подвійним зв'язком з центральним атомом вуглецю. В результаті правило октету виконується для всіх трьох атомів.
- В пентахлорид фосфору (PCl5) правило октету порушується — в цьому з'єднанні навколо центрального атома розташовується 5 зв'язуючих пар. Ця молекула має 5 атомів хлору, які ковалентно пов'язані з центральним атомом фосфору. Таким чином, правило октету виконується для кожного з 5 атомів хлору, але перевищується для атома фосфору.
 Запишіть символ центрального атома.якщо ви маєте справу з багатоатомними ковалентними молекулами, краще почати з центрального атома. Не записуйте Символи всіх атомів одночасно. Залиште достатньо місця навколо центрального атома, щоб можна було розмістити інші символи після того, як ви визначите їх розташування.[7]
Запишіть символ центрального атома.якщо ви маєте справу з багатоатомними ковалентними молекулами, краще почати з центрального атома. Не записуйте Символи всіх атомів одночасно. Залиште достатньо місця навколо центрального атома, щоб можна було розмістити інші символи після того, як ви визначите їх розташування.[7] Зобразіть електронну структуру центрального атома.для кожної незв'язаної пари електронів поставте по 2 маленькі точки навколо центрального атома. Кожну зв'язок зобразіть лінією, що відходить від атома. Подвійні і потрійні зв'язки відобразіть відповідно двома або трьома лініями. Таким чином ви покажете, як інші атоми з'єднані з центральним.[8]
Зобразіть електронну структуру центрального атома.для кожної незв'язаної пари електронів поставте по 2 маленькі точки навколо центрального атома. Кожну зв'язок зобразіть лінією, що відходить від атома. Подвійні і потрійні зв'язки відобразіть відповідно двома або трьома лініями. Таким чином ви покажете, як інші атоми з'єднані з центральним.[8] Додайте інші атоми.кожен атом буде з'єднуватися з центральним. Запишіть символи кожного атома на кінцях ліній, які ви провели від центрального атома. Тим самим ви вкажете на те, що електрони розподіляються між центральним атомом і цими атомами.[9]
Додайте інші атоми.кожен атом буде з'єднуватися з центральним. Запишіть символи кожного атома на кінцях ліній, які ви провели від центрального атома. Тим самим ви вкажете на те, що електрони розподіляються між центральним атомом і цими атомами.[9] Позначте решту електронів.врахуйте кожну зв'язок як два електрони, а подвійну або потрійну зв'язок як чотири або шість електронів відповідно. Потім додайте електронні пари навколо кожного атома, так щоб виконувалося правило октету. Перевірте, чи все правильно: кожна точка відповідає одному електрону, а лінія — двом електронам. У сумі має вийти 8.[10]
Позначте решту електронів.врахуйте кожну зв'язок як два електрони, а подвійну або потрійну зв'язок як чотири або шість електронів відповідно. Потім додайте електронні пари навколо кожного атома, так щоб виконувалося правило октету. Перевірте, чи все правильно: кожна точка відповідає одному електрону, а лінія — двом електронам. У сумі має вийти 8.[10]- Звичайно, виняток становлять ті атоми, які перевищують правило октету, а також атом водню, у якого може бути лише 0 або 2 валентних електрона.
- При утворенні молекули водню два атоми водню з'єднуються ковалентним зв'язком, тому у молекули немає вільних електронів.
Метод3 З 3:
Іони
Метод3 З 3:
 Запишіть символ хімічного елемента.іон позначається тим же символом, що і відповідний атом. Залиште достатньо місця навколо символу, щоб пізніше вказати електрони і додати дужки. Іноді іони являють собою багатоатомні молекули, які містять більше одного атома. В цьому випадку їх позначають шляхом запису символів всіх вхідних в молекулу атомів.[11]
Запишіть символ хімічного елемента.іон позначається тим же символом, що і відповідний атом. Залиште достатньо місця навколо символу, щоб пізніше вказати електрони і додати дужки. Іноді іони являють собою багатоатомні молекули, які містять більше одного атома. В цьому випадку їх позначають шляхом запису символів всіх вхідних в молекулу атомів.[11]- Щоб записати поліатомний іон (наприклад, NO3- або so42-), скористайтеся рекомендаціями, наведеними в попередньому розділі «ковалентні молекули, що складаються з трьох або більше атомів».
 Позначте електрони.зазвичай атоми нейтральні і не володіють позитивним або негативним зарядом. Однак якщо атом втрачає або набуває електрони, його електричний заряд змінюється. В цьому випадку атом стає зарядженою часткою, іоном. Позначте на структурі Льюїса Додаткові електрони або видаліть ті електрони, які атом втратив.[12]
Позначте електрони.зазвичай атоми нейтральні і не володіють позитивним або негативним зарядом. Однак якщо атом втрачає або набуває електрони, його електричний заряд змінюється. В цьому випадку атом стає зарядженою часткою, іоном. Позначте на структурі Льюїса Додаткові електрони або видаліть ті електрони, які атом втратив.[12]- Якщо ви додаєте електрони, не забувайте про правило октету.
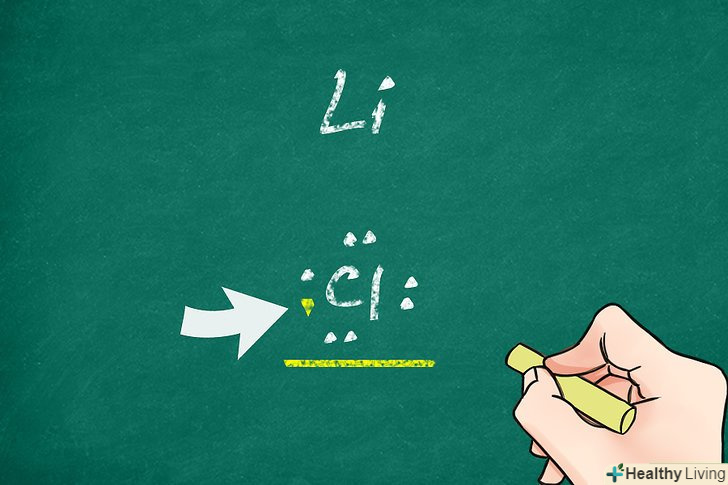
- Якщо атом втрачає електрони, утворюється позитивний іон (катіон). Наприклад, при іонізації атом літію втрачає свій єдиний валентний електрон. Його структура Льюїса являє собою символ» Li " без точок.
- Якщо атом набуває додаткових електронів, він перетворюється на негативний іон (аніон). Має 7 валентних електронів атом хлору при іонізації набуває ще один електрон, в результаті чого у нього утворюється заповнена оболонка з 8 електронів. У цьому випадку структура Льюїса буде являти собою символ "Cl", оточений чотирма парами точок.
 Позначте заряд іона.підрахунок точок навколо кожного атома для того, щоб з'ясувати заряд іона, може виявитися досить виснажливим заняттям. Щоб спростити читання структур Льюїса, на них позначають заряди іонів. Для цього символ елемента (або кілька утворюють поліатомну структуру символів) укладають в квадратні дужки і записують заряд за дужками у верхньому правому куті.[13]
Позначте заряд іона.підрахунок точок навколо кожного атома для того, щоб з'ясувати заряд іона, може виявитися досить виснажливим заняттям. Щоб спростити читання структур Льюїса, на них позначають заряди іонів. Для цього символ елемента (або кілька утворюють поліатомну структуру символів) укладають в квадратні дужки і записують заряд за дужками у верхньому правому куті.[13]- Наприклад, іон магнію з порожньою зовнішньою електронною оболонкою позначають як [Mg]2 + .
Поради
- Точкові структури Льюїса повинні бути однаковими для тих елементів, які належать до однієї періодичної групи, хоча зустрічаються деякі винятки.
Джерела
- ↑ Http://www.chem.ucalgary.ca/courses/351/Carey5th/Ch01/ch1-3depth.html
- ↑ Http://web.chem.ucla.edu/~harding/lewisdots.html
- ↑ Http://web.chem.ucla.edu/~harding/lewisdots.html
- ↑ Http://chemed.chem.purdue.edu/genchem/topicreview/bp/ch8/lewis.html
- ↑ Http://web.chem.ucla.edu/~harding/lewisdots.html
- ↑ Http://www.chem.ucalgary.ca/courses/351/Carey5th/Ch01/ch1-3depth.html
- ↑ Http://chemed.chem.purdue.edu/genchem/topicreview/bp/ch8/lewis.html
- ↑ Http://web.chem.ucla.edu/~harding/lewisdots.html
- ↑ Http://www.chem.ucalgary.ca/courses/351/Carey5th/Ch01/ch1-3depth.html