Валентні електрони знаходяться на зовнішній оболонці атома. Їх кількість визначає число можливих хімічних сполук, які атом може утворити. Кращий спосіб визначити кількість валентних електронів-скористатися періодичною таблицею Менделєєва.
Кроки
Частина1 З 2:
Пошук валентних електронів за допомогою періодичної таблиці
Частина1 З 2:
Неперехідні метали
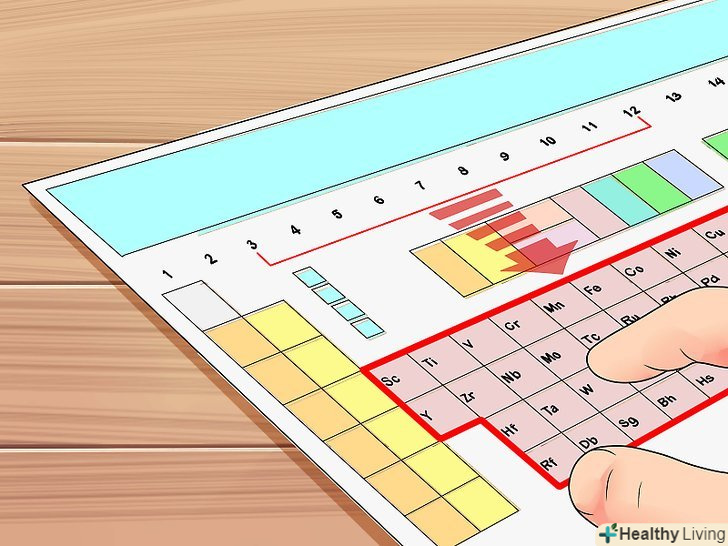
 ВикористовуйтеПеріодичну таблицю хімічних елементів (таблицю Менделєєва). це певним чином розфарбована таблиця, кожна комірка якої містить назву хімічного елемента та іншу важливу інформацію, яку можна використовувати для визначення кількості валентних електронів у конкретному атомі. Таблицю Менделєєва можна знайти в підручнику з хімії або здесь.
ВикористовуйтеПеріодичну таблицю хімічних елементів (таблицю Менделєєва). це певним чином розфарбована таблиця, кожна комірка якої містить назву хімічного елемента та іншу важливу інформацію, яку можна використовувати для визначення кількості валентних електронів у конкретному атомі. Таблицю Менделєєва можна знайти в підручнику з хімії або здесь. Пронумеруйте кожен стовпець періодичної таблиці з 1 по 18 (починаючи з першого стовпця зліва).як правило, всі елементи одного стовпця таблиці Менделєєва мають однакове число валентних електронів. Стовпці-це групи, на які діляться хімічні елементи.[1]
Пронумеруйте кожен стовпець періодичної таблиці з 1 по 18 (починаючи з першого стовпця зліва).як правило, всі елементи одного стовпця таблиці Менделєєва мають однакове число валентних електронів. Стовпці-це групи, на які діляться хімічні елементи.[1]- Наприклад, над воднем (Н) напишіть цифру 1, так як з нього починається перший стовпець, а над гелієм (He) напишіть цифру 18, так як з нього починається вісімнадцятий стовпець.
 Тепер в таблиці Менделєєва знайдіть елемент, число валентних електронів якого ви хочете знайти. ви можете зробити це за символом елемента( букви в кожній комірці), за його атомним номером (число в лівому верхньому кутку кожної комірки) або будь-який інший доступної Вам інформації.
Тепер в таблиці Менделєєва знайдіть елемент, число валентних електронів якого ви хочете знайти. ви можете зробити це за символом елемента( букви в кожній комірці), за його атомним номером (число в лівому верхньому кутку кожної комірки) або будь-який інший доступної Вам інформації.- Наприклад, визначимо число валентних електронів вуглецю (С). Його атомний номер 6 і з нього починається чотирнадцята група.
- У цьому підрозділі ми не розглядаємо перехідні метали, які розташовані в групах з 3 по 12. Ці елементи трохи відрізняються від інших, тому описані тут методи на них не поширюються. Перехідні метали будуть розглянуті в наступному підрозділі.
 Використовуйте номери груп, щоб визначити кількість валентних електронів у неперехідних металах.Цифра, що стоїть в номері групи в розряді одиниць, визначає число валентних електронів в атомах елементів. Іншими словами:
Використовуйте номери груп, щоб визначити кількість валентних електронів у неперехідних металах.Цифра, що стоїть в номері групи в розряді одиниць, визначає число валентних електронів в атомах елементів. Іншими словами:- Група 1: 1 валентний електрон
- Група 2: 2 валентних електрона
- Група 13: 3 валентних електрона
- Група 14: 4 валентних електрона
- Група 15: 5 валентних електронів
- Група 16: 6 валентних електронів
- Група 17: 7 валентних електронів
- Група 18: 8 валентних електрона (за винятком гелію, у якого 2 валентних електрона)
- У нашому прикладі, оскільки вуглець знаходиться в групі 14, можна зробити висновок, що один атом вуглецю має чотири валентні електрони.
Перехідні метали
 Знайдіть елемент у групах з 3 по 12. У цих групах розташовані перехідні метали. У цьому підрозділі ми розповімо, як визначити число валентних електронів в атомах таких елементів. Зауважте, що в деяких елементах число валентних електронів визначити не можна.
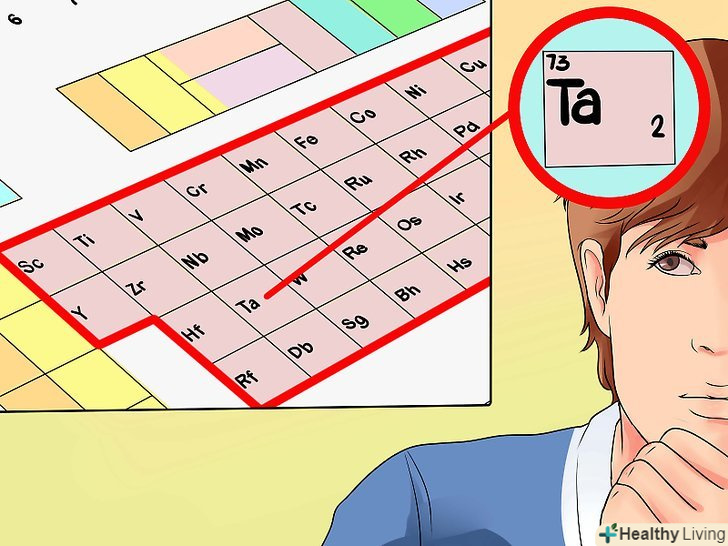
Знайдіть елемент у групах з 3 по 12. У цих групах розташовані перехідні метали. У цьому підрозділі ми розповімо, як визначити число валентних електронів в атомах таких елементів. Зауважте, що в деяких елементах число валентних електронів визначити не можна.- Наприклад, розглянемо тантал( Ta); його атомний номер 73. Далі ми знайдемо число його валентних електронів (або, принаймні, спробуємо це зробити).
- Зверніть увагу, що перехідні метали включають лантаноїди та актиноїди (вони також називаються рідкоземельними металами) — два ряди елементів, які, як правило, розташовані нижче основної таблиці і які починаються з лантану та актинію. Всі ці елементи відносяться до групи 3 періодичної таблиці.
 Щоб зрозуміти, чому складно визначити число валентних електронів у перехідних металів, необхідно дати невелике пояснення про розташування електронів в атомах. [2]
Щоб зрозуміти, чому складно визначити число валентних електронів у перехідних металів, необхідно дати невелике пояснення про розташування електронів в атомах. [2]- В атомі електрони розташовані на електронних орбіталях. Кожна електронна орбіталь може містити тільки якесь певне число електронів, причому заповнюються орбіталі, починаючи з найближчої до ядра атома і закінчуючи найбільш далекою.
- При заповненні електронами зовнішньої орбіталі атома перехідного металу вони стають валентними електронами, але на якийсь час, після чого в роль валентних електронів вступають електрони з інших орбіталей. Це означає, що число валентних електронів може змінюватися.
- Для отримання детальної інформації про валентні електрони прочитайтецю статтю.[3]
 Використовуйте номери груп, щоб визначити кількість валентних електронів у перехідних металах.тут номер групи, як правило, відповідає діапазону можливого числа валентних електронів.[4]
Використовуйте номери груп, щоб визначити кількість валентних електронів у перехідних металах.тут номер групи, як правило, відповідає діапазону можливого числа валентних електронів.[4]- Група 3: 3 валентних електрона
- Група 4: 2-4 валентних електрона
- Група 5: 2-5 валентних електронів
- Група 6: 2-6 валентних електронів
- Група 7: 2-7 валентних електронів
- Група 8: 2 або 3 валентних електрона
- Група 9: 2 або 3 валентних електрона
- Група 10: 2 або 3 валентних електрона
- Група 11: 1 або 2 валентних електрона
- Група 12: 2 валентних електрона
- У нашому прикладі тантал розташований у групі 5, тому можна зробити висновок, що його атом має від двох до п'яти валентних електронів (залежно від ситуації).
Частина2 З 2:
Знаходження валентних електронів за допомогою електронної конфігурації
Частина2 З 2:
 Електронна конфігурація-це формула розташування електронів по електронних орбіталях атома хімічного елемента.іншими словами, це простий і наочний спосіб представлення електронних орбіталей атома з використанням букв і цифр.
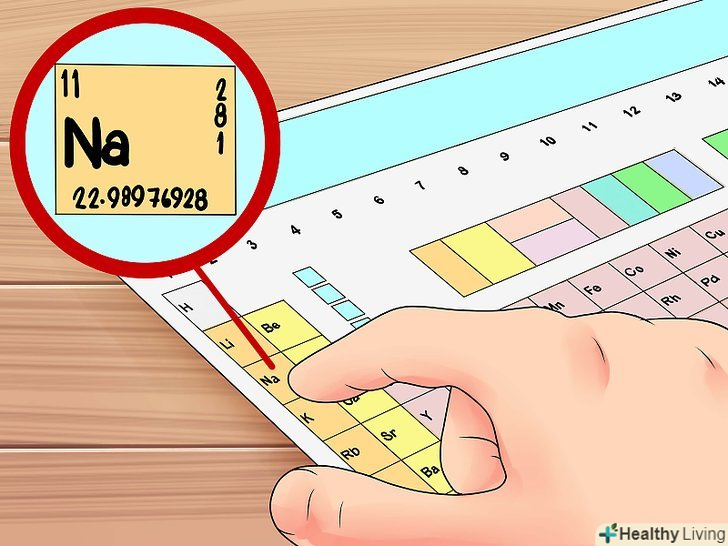
Електронна конфігурація-це формула розташування електронів по електронних орбіталях атома хімічного елемента.іншими словами, це простий і наочний спосіб представлення електронних орбіталей атома з використанням букв і цифр.- Наприклад, розглянемо електронну конфігурацію натрію (Na):
- 1s22s22p63s1
- Зверніть увагу, що електронна конфігурація будується за формулою:
- (цифра) (буква)(надрядкова цифра)(цифра) (буква)(надрядкова цифра)...
- ... і так далі. Тут(цифра)(буква) — це позначення Електронної орбіталі, а (надрядкова цифра) — це число електронів на цій орбіталі.
- У нашому прикладі в атомі натрію 2 електрона на 1S-орбіталі плюс 2 електрона на 2S-орбіталі плюс 6 електронів на 2Р-орбіталі плюс 1 електрон на 3S-орбіталі. Всього 11 електронів, що вірно, так як атомний номер натрію 11.
- Врахуйте, що підрівні електронних оболонок мають певне число електронів. Максимальна кількість електронів для орбіталей наступне:
- S: 2 електрона
- P: 6 електронів
- D: 10 електронів
- F: 14 електронів
- Наприклад, розглянемо електронну конфігурацію натрію (Na):
 Тепер Ви знаєте, як розшифровувати електронну конфігурацію, і зможете знайти число валентних електронів певного елемента (за винятком, звичайно, перехідних металів). якщо електронна конфігурація дана в задачі, перейдіть до наступного кроку. Якщо ні, читайте далі.
Тепер Ви знаєте, як розшифровувати електронну конфігурацію, і зможете знайти число валентних електронів певного елемента (за винятком, звичайно, перехідних металів). якщо електронна конфігурація дана в задачі, перейдіть до наступного кроку. Якщо ні, читайте далі.- Ось повна електронна конфігурація оганесона (Og; атомний номер 118):
- 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f146d107p6
- Тепер, щоб визначити електронну конфігурацію будь-якого елемента, вам просто потрібно заповнити цей шаблон (до тих пір, поки у вас не залишиться електронів). Це простіше, ніж здається. Наприклад, визначте електронну конфігурацію хлору (CL; атомний номер 17), атом якого має 17 електронів:
- 1s22s22p63s23p5
- Зверніть увагу, що загальна кількість електронів дорівнює 17: 2 + 2 + 6 + 2 + 5 = 17. Вам потрібно змінити кількість електронів на останній орбіталі, так як попередні орбіталі такі ж, як в шаблоні (бо повністю заповнені електронами).
- Для отримання детальної інформації про електронні конфігурації прочитайте цю статтю.
- Ось повна електронна конфігурація оганесона (Og; атомний номер 118):
 Орбіталі заповнюються електронами за правилом октету: перші два електрони заповнюють 1S-орбіталь, наступні два електрони заповнюють 2S-орбіталь, наступні шість електронів заповнюють 2Р-орбіталь (і так далі). Коли ми маємо справу з атомами неперехідних металів, ми говоримо, що ці орбіталі утворюють навколо атома "орбітальні оболонки", причому кожна наступна оболонка розташована далі, ніж попередня. Два електрона містить тільки перша оболонка, а всі інші оболонки містять по вісім електронів (крім, знову ж таки, атомів перехідних металів). Це називається правилом октету.
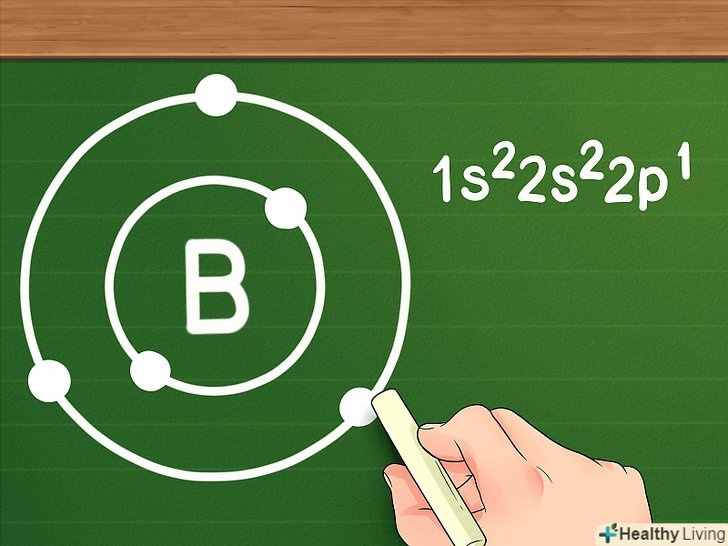
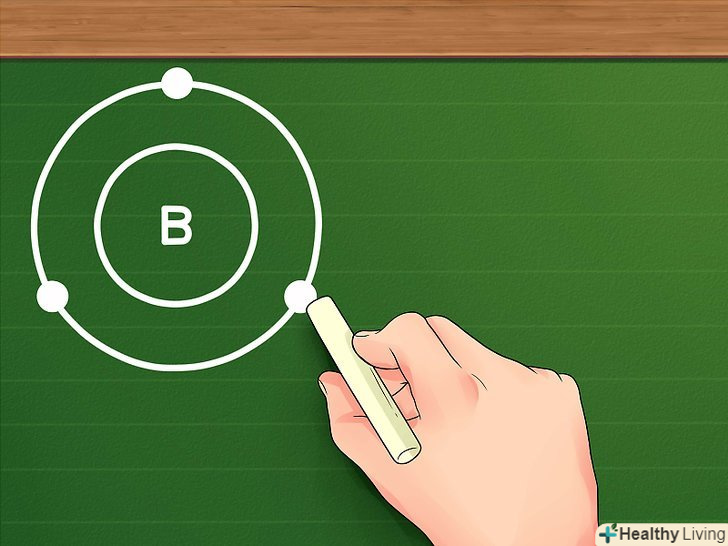
Орбіталі заповнюються електронами за правилом октету: перші два електрони заповнюють 1S-орбіталь, наступні два електрони заповнюють 2S-орбіталь, наступні шість електронів заповнюють 2Р-орбіталь (і так далі). Коли ми маємо справу з атомами неперехідних металів, ми говоримо, що ці орбіталі утворюють навколо атома "орбітальні оболонки", причому кожна наступна оболонка розташована далі, ніж попередня. Два електрона містить тільки перша оболонка, а всі інші оболонки містять по вісім електронів (крім, знову ж таки, атомів перехідних металів). Це називається правилом октету.- Наприклад, розглянемо бор (B). Його атомний номер 5, тобто атом бору включає п'ять електронів, а його електронна конфігурація виглядає наступним чином: 1s22s22P1. Так як перша орбітальна оболонка має тільки два електрона, то можна зробити висновок, що у бора тільки дві оболонки: перша з двома електронами (на 1S-орбіталі), а друга з трьома (на 2S - і 2р-орбіталях).
- В якості іншого прикладу розглянемо хлор( Cl), у якого три орбітальні оболонки: перша з двома електронами на 1S-орбіталі, друга з двома електронами на 2S-орбіталі і шістьма електронами на 2Р-орбіталі, третя з двома електронами на 3S-орбіталі і п'ятьма електронами на 3P-орбіталі.
 Знайдіть число електронів на зовнішній оболонці.це і буде число валентних електронів певного елемента. Якщо зовнішня оболонка повністю заповнена (іншими словами, якщо вона має вісім електронів або два електрони в разі першої оболонки), то елемент є інертним і не буде легко вступати в реакцію з іншими елементами. Знову ж таки, ці правила не поширюються на перехідні метали.
Знайдіть число електронів на зовнішній оболонці.це і буде число валентних електронів певного елемента. Якщо зовнішня оболонка повністю заповнена (іншими словами, якщо вона має вісім електронів або два електрони в разі першої оболонки), то елемент є інертним і не буде легко вступати в реакцію з іншими елементами. Знову ж таки, ці правила не поширюються на перехідні метали.- Наприклад, розглянемо бор. Так як на зовнішній оболонці бору знаходяться три електрона, то можна зробити висновок, що у бору три валентних електрона.
 Використовуйте рядки таблиці Менделєєва для визначення числа орбітальних оболонок.рядки періодичної таблиці хімічних елементів називаються періодами. Кожен період відповідає кількості електронних оболонок атомів. Ви можете використовувати це для визначення числа валентних електронів елемента-просто порахуйте порядковий номер елемента в періоді, починаючи зліва. Врахуйте, що даний метод не поширюється на перехідні метали.
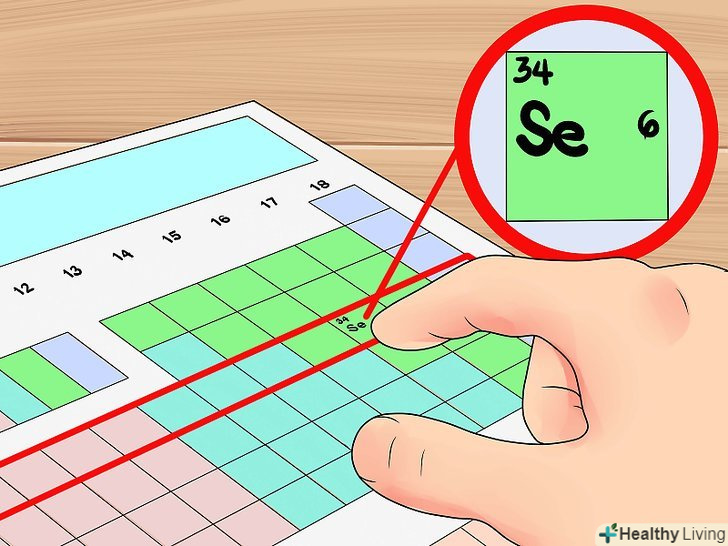
Використовуйте рядки таблиці Менделєєва для визначення числа орбітальних оболонок.рядки періодичної таблиці хімічних елементів називаються періодами. Кожен період відповідає кількості електронних оболонок атомів. Ви можете використовувати це для визначення числа валентних електронів елемента-просто порахуйте порядковий номер елемента в періоді, починаючи зліва. Врахуйте, що даний метод не поширюється на перехідні метали.- Наприклад, ми знаємо, що селен має чотири орбітальні оболонки, оскільки цей елемент знаходиться в четвертому періоді. Так як це шостий елемент (зліва) четвертого періоду (без урахування перехідних металів), можна зробити висновок, що зовнішня четверта оболонка містить шість електронів, і, таким чином, у селену шість валентних електрона.
Поради
- Зверніть увагу, що електронні конфігурації можуть бути записані в скороченому вигляді з використанням благородних газів (елементи групи 18). Наприклад, електронну конфігурацію натрію можна записати так: [Ne]3S1 — по суті, вона нагадує електронну конфігурацію неону, але з одним додатковим електроном на 3S-орбіталі.[5]
- У перехідних металів є валентні підрівні, незаповнені повністю. Визначення точного числа валентних електронів в перехідних металах включає в себе принципи квантової теорії і не розглядається в даній статті.
- Зверніть увагу, що форма (вид) періодичної таблиці хімічних елементів може відрізнятися в різних країнах. Тому переконайтеся, що Ви користуєтеся формою періодичної таблиці хімічних елементів, яка прийнята у вашій країні (щоб уникнути помилок).
- Слідкуйте за діями (віднімання або додавання) при знаходженні валентних електронів.
Що вам знадобиться
- Періодична таблиця хімічних елементів (таблиця Менделєєва)
- олівець
- Папір
Джерела
- ↑ Http://www.chem4kids.com/files/elem_pertable.html
- ↑ Http://dl.clackamas.edu/ch104-06/valence_electrons.htm
- ↑ Https://ru.wikipedia.org/wiki/%D0%92%D0%B0%D0%BB%D0%B5%D0%BD%D1%82%D0%BD%D1%8B%D0%B9_%D1%8D%D0%BB%D0%B5%D0%BA%D1%82%D1%80%D0%BE%D0%BD
- ↑ Http://dl.clackamas.edu/ch104-06/valence_electrons.htm
- ↑ Http://crescentok.com/staff/jaskew/isr/chemistry/class4.htm