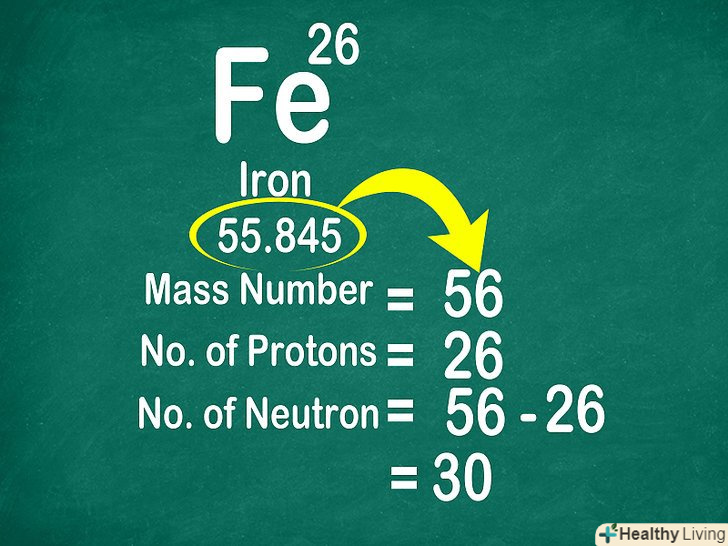Якщо таблиця Менделєєва здається вам складною для розуміння, ви не самотні! Хоча буває непросто зрозуміти її принципи, вміння працювати з нею допоможе при вивченні природничих наук. Для початку вивчіть структуру таблиці і те, яку інформацію можна дізнатися з неї про кожному хімічному елементі. Потім можна приступити до вивчення властивостей кожного елемента. І нарешті, за допомогою таблиці Менделєєва можна визначити число нейтронів в атомі того чи іншого хімічного елемента.
Кроки
Частина1З 3:
Структура таблиці
Частина1З 3:
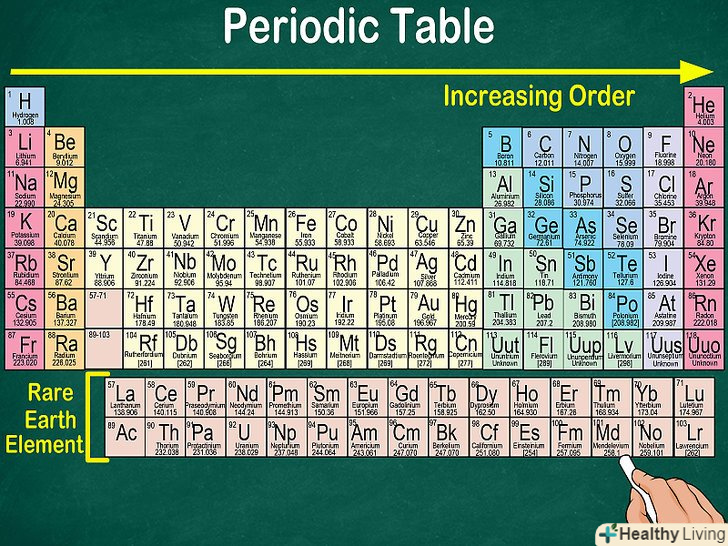
 Таблиця Менделєєва, або періодична система хімічних елементів, починається в лівому верхньому кутку і закінчується в кінці останнього рядка таблиці (в нижньому правому куті). елементи в таблиці розташовані зліва направо в порядку зростання їх атомного номера. Атомний номер показує, скільки протонів міститься в одному атомі. Крім того, зі збільшенням атомного номера зростає і атомна маса. Таким чином, по розташуванню того чи іншого елемента в таблиці Менделєєва можна визначити його атомну масу.
Таблиця Менделєєва, або періодична система хімічних елементів, починається в лівому верхньому кутку і закінчується в кінці останнього рядка таблиці (в нижньому правому куті). елементи в таблиці розташовані зліва направо в порядку зростання їх атомного номера. Атомний номер показує, скільки протонів міститься в одному атомі. Крім того, зі збільшенням атомного номера зростає і атомна маса. Таким чином, по розташуванню того чи іншого елемента в таблиці Менделєєва можна визначити його атомну масу.- Атомна маса збільшується зліва направо і зверху вниз, оскільки в атомах елементів з великим номером міститься більше протонів і нейтронів. Кожен наступний елемент містить більше протонів, ніж попередній, тому зростає і його атомна маса.
- В атомній масі не враховуються електрони, оскільки вони важать набагато менше, ніж протони і нейтрони.[1]
 Як видно, кожен наступний елемент містить на один протон більше, ніж попередній йому елемент.це очевидно, якщо подивитися на атомні номери. Атомні номери зростають на один при русі зліва направо. Оскільки елементи розташовані по групах, деякі комірки таблиці залишаються порожніми.[2]
Як видно, кожен наступний елемент містить на один протон більше, ніж попередній йому елемент.це очевидно, якщо подивитися на атомні номери. Атомні номери зростають на один при русі зліва направо. Оскільки елементи розташовані по групах, деякі комірки таблиці залишаються порожніми.[2]- Наприклад, перший рядок таблиці містить водень, який має атомний номер 1, і гелій з атомним номером 2. Однак вони розташовані на протилежних краях, так як належать до різних груп.
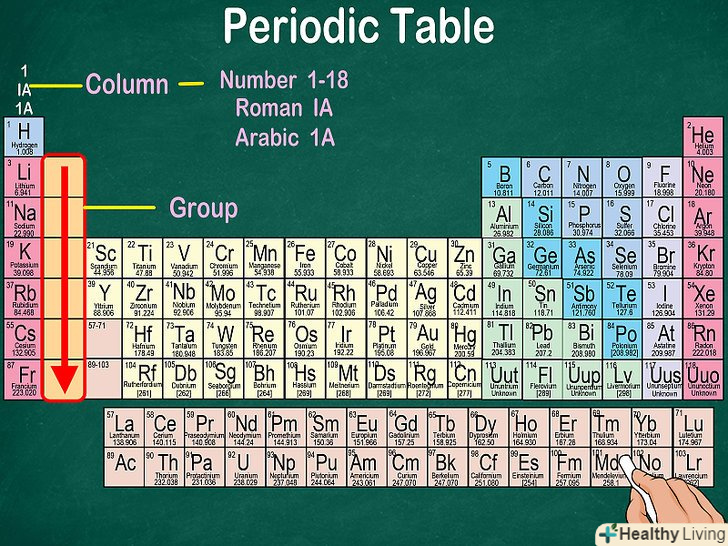
 Дізнайтеся про групи, які включають в себе елементи зі схожими фізичними і хімічними властивостями. елементи кожної групи розташовуються у відповідній вертикальній колонці. Як правило, вони позначаються одним кольором, що допомагає визначити елементи зі схожими фізичними і хімічними властивостями і передбачити їх поведінку.[3] всі елементи тієї чи іншої групи мають однакове число електронів на зовнішній оболонці.[4]
Дізнайтеся про групи, які включають в себе елементи зі схожими фізичними і хімічними властивостями. елементи кожної групи розташовуються у відповідній вертикальній колонці. Як правило, вони позначаються одним кольором, що допомагає визначити елементи зі схожими фізичними і хімічними властивостями і передбачити їх поведінку.[3] всі елементи тієї чи іншої групи мають однакове число електронів на зовнішній оболонці.[4]- Водень можна віднести як до групи лужних металів, так і до групи галогенів. У деяких таблицях його вказують в обох групах.
- У більшості випадків групи пронумеровані від 1 до 18, і номери ставляться вгорі або внизу таблиці. Номери можуть бути вказані римськими (наприклад,IA) або арабськими (наприклад, 1A або 1) цифрами.
- При русі вздовж колонки зверху вниз говорять, що ви «переглядаєте групу».
 Дізнайтеся, чому в таблиці присутні порожні комірки. елементи впорядковані не тільки відповідно до їх атомним номером, але і по групах (елементи однієї групи мають схожі фізичними і хімічними властивостями). Завдяки цьому можна легше зрозуміти, як поводиться той чи інший елемент. Однак з ростом атомного номера не завжди знаходяться елементи, які потрапляють у відповідну групу, тому в таблиці зустрічаються порожні комірки.[5]
Дізнайтеся, чому в таблиці присутні порожні комірки. елементи впорядковані не тільки відповідно до їх атомним номером, але і по групах (елементи однієї групи мають схожі фізичними і хімічними властивостями). Завдяки цьому можна легше зрозуміти, як поводиться той чи інший елемент. Однак з ростом атомного номера не завжди знаходяться елементи, які потрапляють у відповідну групу, тому в таблиці зустрічаються порожні комірки.[5]- Наприклад, перші 3 рядки мають порожні комірки, оскільки перехідні метали зустрічаються лише з атомного номера 21.
- Елементи з атомними номерами з 57 по 102 відносяться до рідкоземельних елементів, і зазвичай їх виносять в окрему підгрупу в нижньому правому куті таблиці.
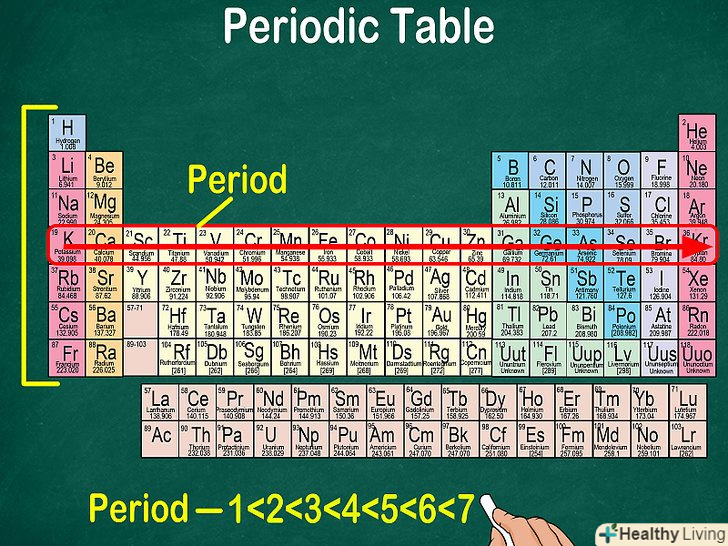
 Кожен рядок таблиці являє собою період.всі елементи одного періоду мають однакове число атомних орбіталей, на яких розташовані електрони в атомах. Кількість орбіталей відповідає номеру періоду. Таблиця містить 7 рядків, тобто 7 періодів.[6]
Кожен рядок таблиці являє собою період.всі елементи одного періоду мають однакове число атомних орбіталей, на яких розташовані електрони в атомах. Кількість орбіталей відповідає номеру періоду. Таблиця містить 7 рядків, тобто 7 періодів.[6]- Наприклад, атоми елементів першого періоду мають одну орбіталь, а атоми елементів сьомого періоду — 7 орбіталей.
- Як правило, періоди позначаються цифрами від 1 до 7 зліва таблиці.
- При русі вздовж рядка зліва направо говорять, що ви «переглядаєте період».
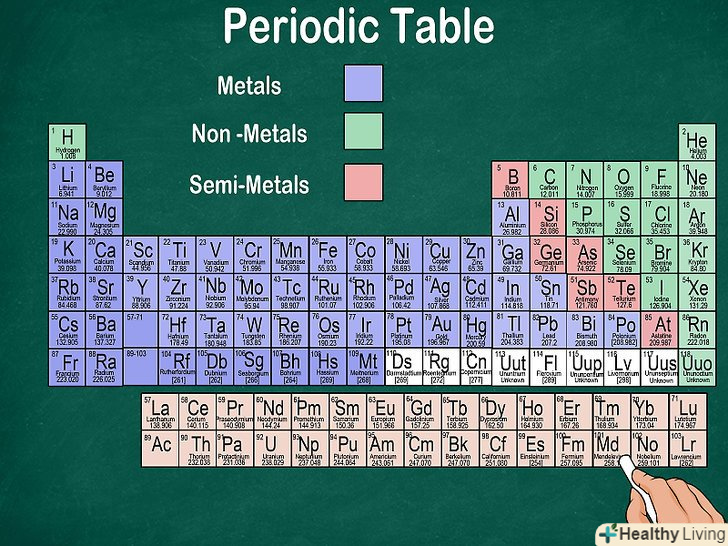
 Навчіться розрізняти метали, металоїди і неметали.ви краще будете розуміти властивості того чи іншого елемента, якщо зможете визначити, до якого типу він відноситься. Для зручності в більшості таблиць метали, металоїди і неметали позначаються різними кольорами. Метали знаходяться в лівій, а неметали - в правій частині таблиці. Металоїди розташовані між ними.[7]
Навчіться розрізняти метали, металоїди і неметали.ви краще будете розуміти властивості того чи іншого елемента, якщо зможете визначити, до якого типу він відноситься. Для зручності в більшості таблиць метали, металоїди і неметали позначаються різними кольорами. Метали знаходяться в лівій, а неметали - в правій частині таблиці. Металоїди розташовані між ними.[7]- Пам'ятайте, що за властивостями водень можна віднести як до лужних металів, так і до галогенів, тому він може мати різний колір і розташовуватися в двох осередках.
- Металеві елементи блищать, є твердими при кімнатній температурі (за винятком ртуті), добре проводять тепло і електричний заряд і досить пластичні.
- Неметали не мають вираженого блиску, погано проводять тепло і електричний заряд, мають низьку пластичність. Як правило, при кімнатній температурі неметалеві елементи являють собою газ, але при певних температурах і тисках вони можуть приймати рідкий або твердий стан.
- Металоїди поєднують в собі властивості металів і неметалів.[8]
Частина2З 3:
Позначення елементів
Частина2З 3:
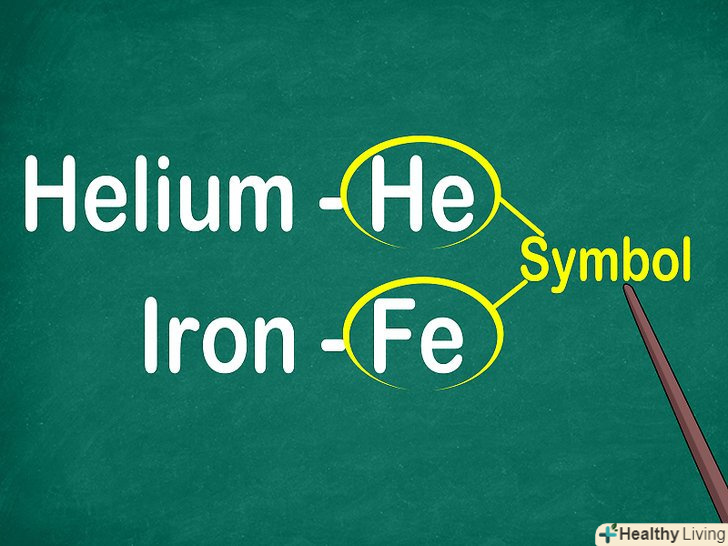
 Кожен елемент позначається однією або двома латинськими літерами.як правило, символ елемента наведено великими літерами в центрі відповідної комірки. Символ являє собою скорочену назву елемента, яке збігається в більшості мов. При проведенні експериментів і роботі з хімічними рівняннями зазвичай використовуються символи елементів, тому корисно пам'ятати їх.[9]
Кожен елемент позначається однією або двома латинськими літерами.як правило, символ елемента наведено великими літерами в центрі відповідної комірки. Символ являє собою скорочену назву елемента, яке збігається в більшості мов. При проведенні експериментів і роботі з хімічними рівняннями зазвичай використовуються символи елементів, тому корисно пам'ятати їх.[9]- Зазвичай символи елементів є скороченням їх латинської назви, хоча для деяких, особливо недавно відкритих елементів, вони отримані з загальноприйнятої назви. Наприклад, гелій позначається символом He, що близько до загальноприйнятої назви в більшості мов. У той же час залізо позначається як Fe, що є скороченням його латинської назви.
 Зверніть увагу на повну назву елемента, якщо вона наведена в таблиці. це» ім'я " елемента використовується в звичайних текстах. Наприклад, "гелій «і» вуглець" є назвами елементів. Зазвичай, хоча і не завжди, повні назви елементів вказуються під їх хімічним символом.[10]
Зверніть увагу на повну назву елемента, якщо вона наведена в таблиці. це» ім'я " елемента використовується в звичайних текстах. Наприклад, "гелій «і» вуглець" є назвами елементів. Зазвичай, хоча і не завжди, повні назви елементів вказуються під їх хімічним символом.[10]- Іноді в таблиці не вказуються назви елементів і наводяться лише їх хімічні символи.
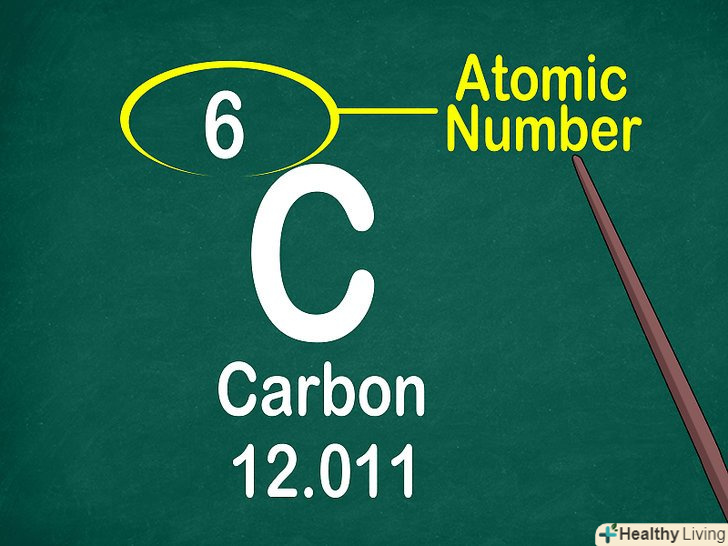
 Знайдіть атомний номер.зазвичай атомний номер елемента розташований вгорі відповідної комірки, посередині або в кутку. Він може також перебувати під символом або назвою елемента. Елементи мають атомні номери від 1 до 118.[11]
Знайдіть атомний номер.зазвичай атомний номер елемента розташований вгорі відповідної комірки, посередині або в кутку. Він може також перебувати під символом або назвою елемента. Елементи мають атомні номери від 1 до 118.[11]- Атомний номер завжди є цілим числом.
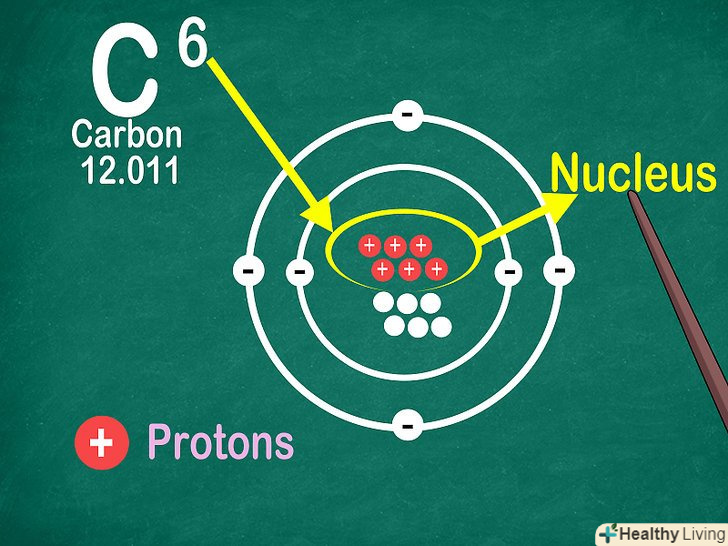
 Пам'ятайте про те, що атомний номер відповідає числу протонів в атомі.всі атоми того чи іншого елемента містять однакову кількість протонів. На відміну від електронів, кількість протонів в атомах елемента залишається постійною. В іншому випадку вийшов би інший хімічний елемент![12]
Пам'ятайте про те, що атомний номер відповідає числу протонів в атомі.всі атоми того чи іншого елемента містять однакову кількість протонів. На відміну від електронів, кількість протонів в атомах елемента залишається постійною. В іншому випадку вийшов би інший хімічний елемент![12]- За атомним номером елемента можна також визначити кількість електронів і нейтронів в атомі.
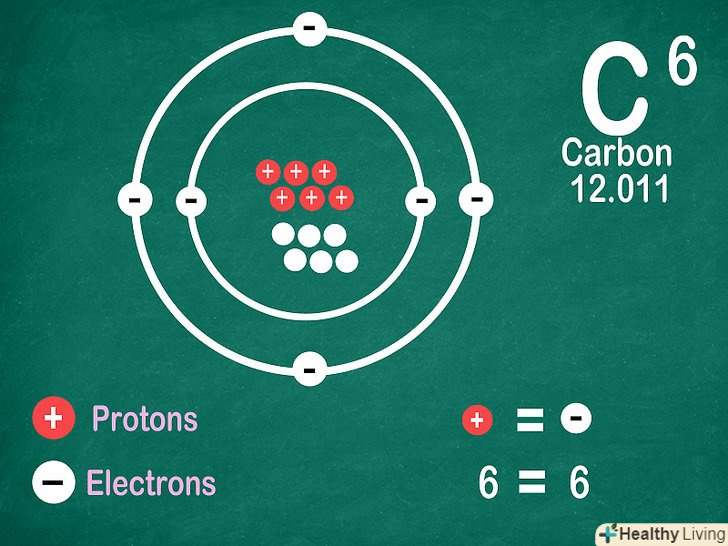
 Зазвичай кількість електронів дорівнює числу протонів.винятком є той випадок, коли атом іонізований. Протони мають позитивний, а електрони — негативний заряд. Оскільки атоми зазвичай нейтральні, вони містять однакову кількість електронів і протонів. Тим не менш, атом може захоплювати електрони або втрачати їх, і в цьому випадку він іонізується.[13]
Зазвичай кількість електронів дорівнює числу протонів.винятком є той випадок, коли атом іонізований. Протони мають позитивний, а електрони — негативний заряд. Оскільки атоми зазвичай нейтральні, вони містять однакову кількість електронів і протонів. Тим не менш, атом може захоплювати електрони або втрачати їх, і в цьому випадку він іонізується.[13]- Іони мають електричний заряд. Якщо в іоні більше протонів, то він володіє позитивним зарядом, і в цьому випадку після символу елемента ставиться знак «плюс». Якщо іон містить більше електронів, він має негативний заряд, що позначається знаком «мінус».
- Знаки "плюс» і "мінус" не ставляться, якщо атом не є іоном.
Частина3З 3:
Обчислення кількості нейтронів по атомній масі
Частина3З 3:
 Знайдіть атомну масу.зазвичай атомну масу вказують внизу комірки, під символом елемента. Атомна маса являє собою суму мас частинок, що складають ядро атома, тобто протонів і нейтронів. Однак елементи мають ізотопи, тому атомна маса є середньою величиною з урахуванням їх поширеності в природі.[14]
Знайдіть атомну масу.зазвичай атомну масу вказують внизу комірки, під символом елемента. Атомна маса являє собою суму мас частинок, що складають ядро атома, тобто протонів і нейтронів. Однак елементи мають ізотопи, тому атомна маса є середньою величиною з урахуванням їх поширеності в природі.[14]- Оскільки атомна маса являє собою середню величину, для більшості елементів вона записується у вигляді десяткового дробу.
- Хоча може здатися, що атомна маса завжди зростає при русі зліва направо і зверху вниз, це справедливо не у всіх випадках.
- Знайдіть масове число конкретного елемента.оскільки в атомній масі враховуються всі ізотопи елемента, для визначення масового числа досить округлити наведену в таблиці атомну масу до найближчого цілого числа.[15]
- Наприклад, атомна маса вуглецю становить 12,011, після округлення отримуємо 12. Для заліза, атомна маса якого дорівнює 55,847, отримуємо 56.
 Відніміть з масового числа атома його атомний номер, щоб знайти кількість нейтронів.маса атома представляє суму мас протонів і нейтронів. Зважаючи на це можна легко визначити число нейтронів-досить відняти з масового числа атомний номер, тобто кількість протонів![16]
Відніміть з масового числа атома його атомний номер, щоб знайти кількість нейтронів.маса атома представляє суму мас протонів і нейтронів. Зважаючи на це можна легко визначити число нейтронів-досить відняти з масового числа атомний номер, тобто кількість протонів![16]- Використовуйте наступну формулу: число нейтронів = масове число-Число протонів.
- Наприклад, масове число вуглецю дорівнює 12, а атом вуглецю має 6 протонів. Оскільки 12 – 6 = 6, атом вуглецю містить 6 нейтронів.
- Масове число заліза становить 56, і його атом містить 26 протонів. Так як 56 – 26 = 30, в атомі заліза міститься 30 нейтронів.
- Ізотопи елементів мають різну кількість нейтронів, завдяки чому змінюється їх атомна маса.
Поради
- Багатьом складно освоїти таблицю Менделєєва. Не турбуйтеся, якщо зіткнетеся з певними труднощами!
- Хоча кольори можуть змінюватися, вони передають одну і ту ж інформацію.
- Зустрічаються спрощені таблиці. Наприклад, в таблиці можуть міститися лише Символи елементів і їх атомні номери. Виберіть таку таблицю, яка підходить для ваших цілей.
Джерела
- ↑ Http://www.csun.edu/~psk17793/G%20Chemistry/reading_the_periodic_table.htm
- ↑ Http://www.csun.edu/~psk17793/G%20Chemistry/reading_the_periodic_table.htm
- ↑ Http://www.csun.edu/~psk17793/G%20Chemistry/reading_the_periodic_table.htm
- ↑ Http://www.chem4kids.com/files/elem_pertable.html
- ↑ Http://www.csun.edu/~psk17793/G%20Chemistry/reading_the_periodic_table.htm
- ↑ Http://www.chem4kids.com/files/elem_pertable.html
- ↑ Http://www.csun.edu/~psk17793/G%20Chemistry/reading_the_periodic_table.htm
- ↑ Http://www.csun.edu/~psk17793/G%20Chemistry/reading_the_periodic_table.htm
- ↑ Http://www.chem4kids.com/files/elem_pertable.html
- ↑ Http://www.chem4kids.com/files/elem_pertable.html
- ↑ Http://www.chem4kids.com/files/elem_pertable.html
- ↑ Http://education.jlab.org/qa/pen_number.html
- ↑ Http://education.jlab.org/qa/pen_number.html
- ↑ Https://education.jlab.org/qa/pen_number.html
- ↑ Https://education.jlab.org/qa/pen_number.html
- ↑ Https://education.jlab.org/qa/pen_number.html