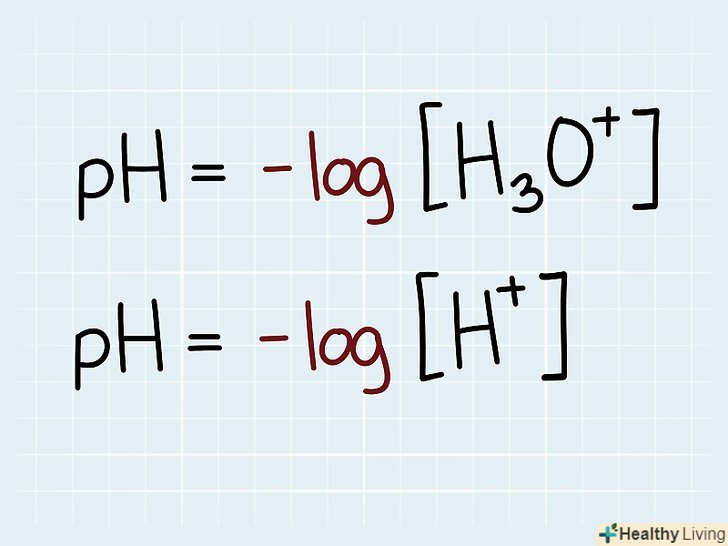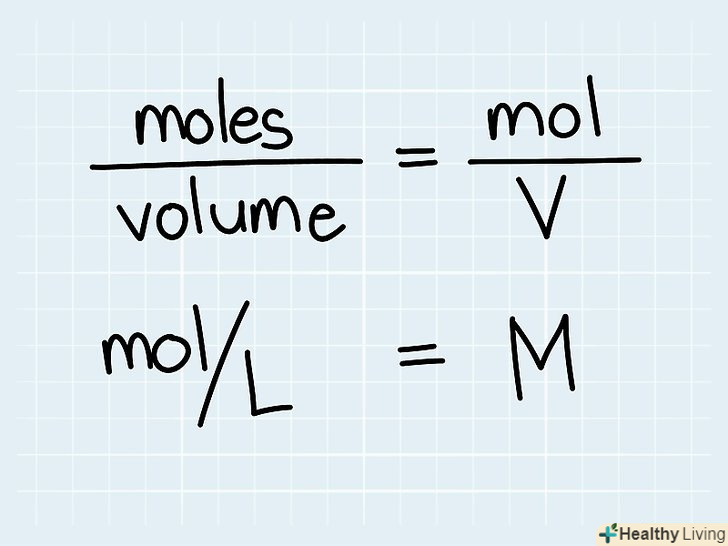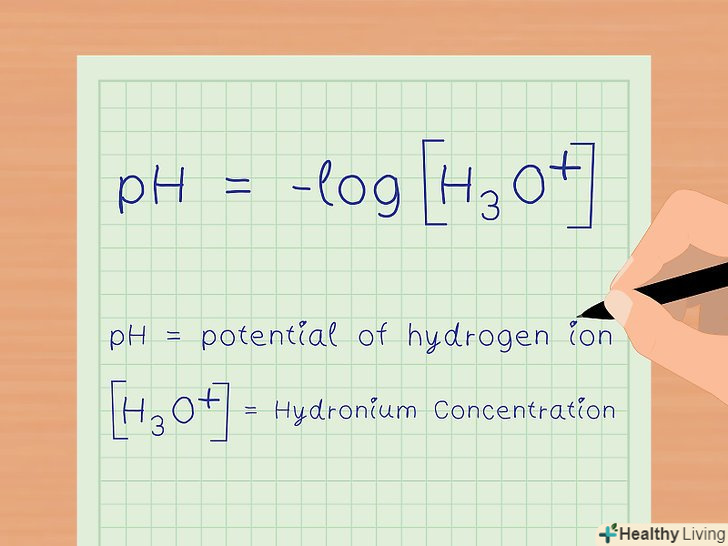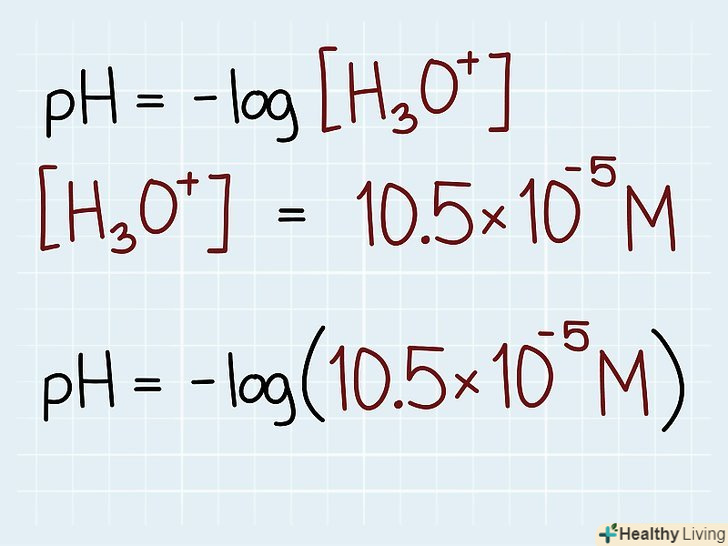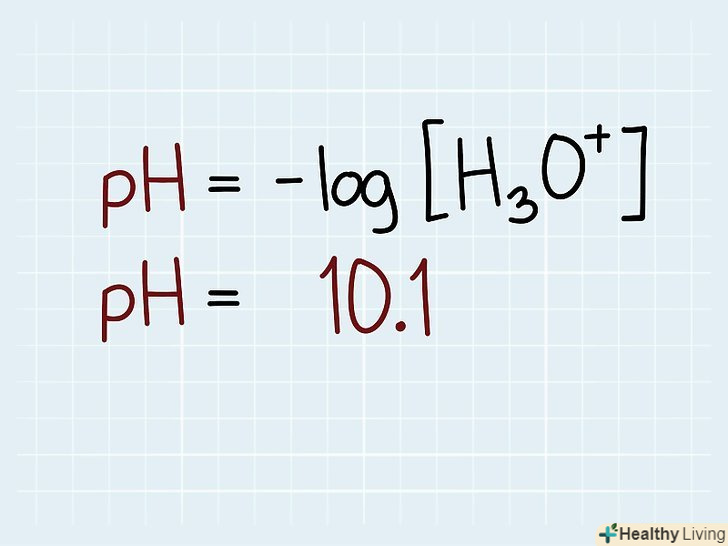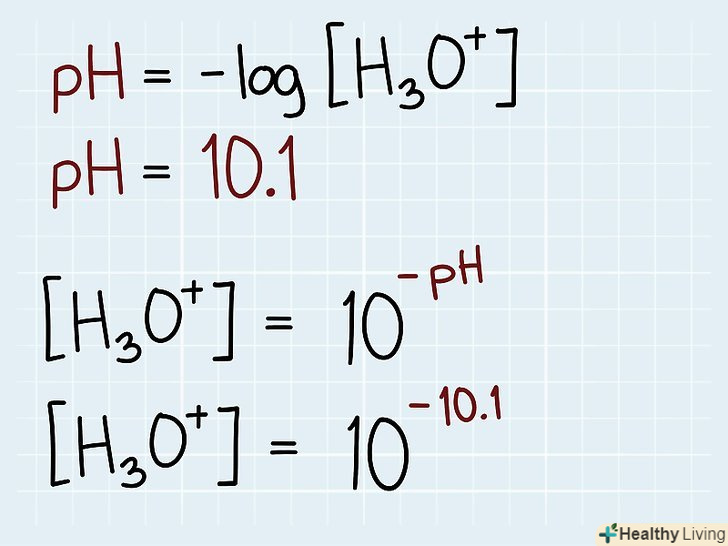У побуті під pH мають на увазі зазвичай шкалу, використовувану для опису нейтральності або, навпаки, нестачі нейтральності тієї чи іншої речовини. У науковому значенні величина pH відповідає кількості іонів в хімічному розчині. Якщо ви вивчаєте хімію або пов'язані з нею предмети, вам може знадобитися розрахувати рівень pH, грунтуючись на концентрації речовин в розчині. Значення pH знаходиться за такою формулою: pH = -lg[H3O+].
Кроки
Метод1З 3:
Що таке pH
Метод1З 3:
 Ознайомтеся з поняттям pH.Величина pH відповідає концентрації іонів водню в розчині. Розчин з підвищеною концентрацією іонів водню називається кислотним, а розчин зі зниженою концентрацією цих іонів – лужним.[1] іони водню коротко позначають як H + . Їх можна представляти і в складі сполуки, тоді вони називаються гідроксонієм і записуються як H30+.
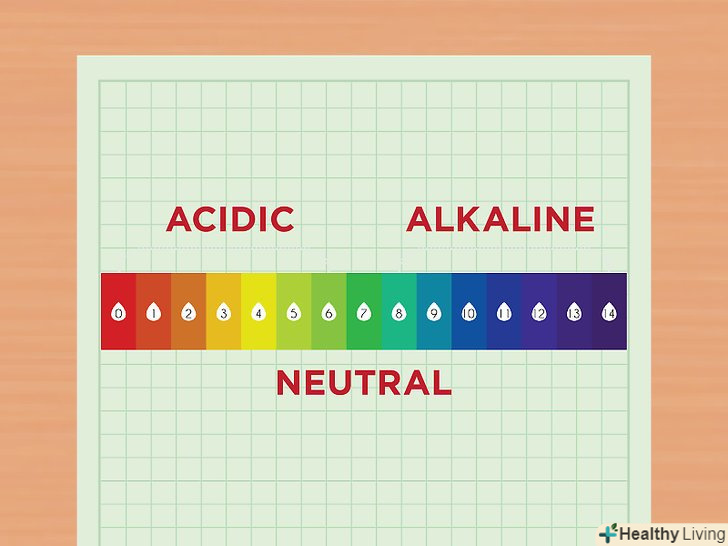
Ознайомтеся з поняттям pH.Величина pH відповідає концентрації іонів водню в розчині. Розчин з підвищеною концентрацією іонів водню називається кислотним, а розчин зі зниженою концентрацією цих іонів – лужним.[1] іони водню коротко позначають як H + . Їх можна представляти і в складі сполуки, тоді вони називаються гідроксонієм і записуються як H30+.- Ознайомтеся зі шкалою pH. Значення на шкалі pH змінюються від 1 до 13. Чим менше число, тим більше кислотним є даний розчин. І навпаки, чим вище значення, тим більш лужним є розчин.[2] наприклад, pH апельсинового соку становить 2, оскільки цей сік являє собою досить кислотну рідину. У хлорного відбілювача pH одно 12, так як в ньому багато лугу.[3] в середині шкали розташовуються відносно нейтральні розчини, такі як вода, pH якої становить 7.
- Різниця між двома розчинами на 1 пункт за шкалою pH означає, що вони розрізняються по кислотності в 10 разів. Наприклад, якщо взяти два розчини зі значеннями pH 6 і 7, кислотність першого розчину з pH 6 буде вище кислотності другого розчину з pH 7 в 10 разів. А, наприклад, кислотність розчину з pH 6 вище кислотності розчину з pH 8 в 100 разів.[4]
 Запам'ятайте рівняння для визначення pH.Шкала pH обчислюється за допомогою негативного десяткового логарифма. Негативний десятковий логарифм відповідає числу нулів, що стоять перед одиницею, включаючи і нуль цілих: наприклад, негативний десятковий логарифм числа 0,1 дорівнює 1, числа 0,01 — 2, і так далі.[5] Формула для знаходження pH виглядає наступним чином: pH = -lg[H3O+].
Запам'ятайте рівняння для визначення pH.Шкала pH обчислюється за допомогою негативного десяткового логарифма. Негативний десятковий логарифм відповідає числу нулів, що стоять перед одиницею, включаючи і нуль цілих: наприклад, негативний десятковий логарифм числа 0,1 дорівнює 1, числа 0,01 — 2, і так далі.[5] Формула для знаходження pH виглядає наступним чином: pH = -lg[H3O+].- Іноді формулу записують у вигляді pH = - lg[H + ]. Неважливо, чи варто в рівнянні H3O + або H + , обидві форми запису рівноцінні.
- Для знаходження pH необов'язково вміти розраховувати десятковий логарифм, так як практично в кожному науковому або інженерному калькуляторі є опція його обчислення.
 Ознайомтеся з поняттям концентрації.концентрація будь-якої речовини відповідає числу частинок цієї речовини, присутніх в розчині.[6] як правило, концентрація виражається в кількості молей на одиницю об'єму і позначається як m/V, або M. у хімічних лабораторіях концентрації розчинів пишуть на пляшках з ними. Якщо ви вирішуєте хімічну задачу, концентрація може бути дана в умові, або її потрібно знайти.
Ознайомтеся з поняттям концентрації.концентрація будь-якої речовини відповідає числу частинок цієї речовини, присутніх в розчині.[6] як правило, концентрація виражається в кількості молей на одиницю об'єму і позначається як m/V, або M. у хімічних лабораторіях концентрації розчинів пишуть на пляшках з ними. Якщо ви вирішуєте хімічну задачу, концентрація може бути дана в умові, або її потрібно знайти.
Метод2 З 3:
Розрахунок pH за відомою концентрацією
Метод2 З 3:
 Згадайте формулу для знаходження pH.ось ця формула: pH = - lg[H3O + ].[7] переконайтеся в тому, що Ви знайомі з усіма елементами, що входять в дану формулу. Подивіться, яка величина відповідає концентрації.
Згадайте формулу для знаходження pH.ось ця формула: pH = - lg[H3O + ].[7] переконайтеся в тому, що Ви знайомі з усіма елементами, що входять в дану формулу. Подивіться, яка величина відповідає концентрації.- В хімії квадратні дужки означають концентрацію чого-небудь. Так що формула для розрахунку pH читається як»pH дорівнює негативному логарифму концентрації гідроксоній-іонів".
 Визначте дійсну концентрацію. уважно прочитайте умову задачі. Знайдіть у вихідних даних концентрацію кислоти або лугу. Запишіть повну формулу на листку паперу, підставивши в неї відомі величини.[8] щоб не виникло плутанини, поруч з числами завжди вказуйте одиниці виміру.
Визначте дійсну концентрацію. уважно прочитайте умову задачі. Знайдіть у вихідних даних концентрацію кислоти або лугу. Запишіть повну формулу на листку паперу, підставивши в неї відомі величини.[8] щоб не виникло плутанини, поруч з числами завжди вказуйте одиниці виміру.- Наприклад, якщо концентрація становить 1,05 x 105 M, запишіть формулу для розрахунку pH в наступному вигляді: pH = -lg[1,05 x 105 M]
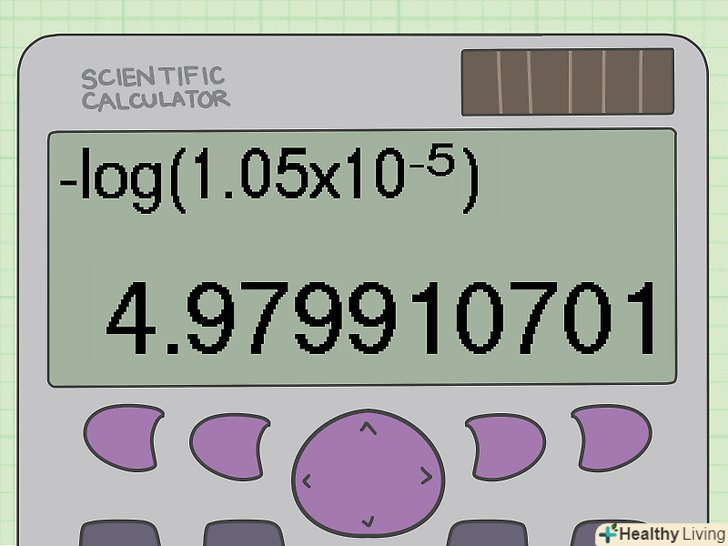
 Обчисліть pH.для цього зручно використовувати науковий калькулятор. Спочатку введіть знак мінуса, натиснувши кнопку"+/ -». Потім натисніть кнопку "log", відповідну десятковому логарифму (в англійській мові десятковий логарифм позначається як log). На екрані відобразиться» - log".[9] потім натисніть ліву дужку і введіть концентрацію. При необхідності не забудьте вказати значення ступеня.[10] після цього закрийте дужки.[11] в результаті на екрані калькулятора ви побачите " - log(1,05x105). Натиснути «=». У вас повинно вийти значення pH, приблизно рівне 4,98.
Обчисліть pH.для цього зручно використовувати науковий калькулятор. Спочатку введіть знак мінуса, натиснувши кнопку"+/ -». Потім натисніть кнопку "log", відповідну десятковому логарифму (в англійській мові десятковий логарифм позначається як log). На екрані відобразиться» - log".[9] потім натисніть ліву дужку і введіть концентрацію. При необхідності не забудьте вказати значення ступеня.[10] після цього закрийте дужки.[11] в результаті на екрані калькулятора ви побачите " - log(1,05x105). Натиснути «=». У вас повинно вийти значення pH, приблизно рівне 4,98.
Метод3 З 3:
Розрахунок концентрації за відомим значенням pH
Метод3 З 3:
 Визначте, що дано і що потрібно знайти.запишіть формулу для обчислення pH. Після цього з'ясуйте відомі величини, виписавши їх значення під формулою. Наприклад, якщо відомо, що pH дорівнює 10,1, запишіть це число під pH у формулі.
Визначте, що дано і що потрібно знайти.запишіть формулу для обчислення pH. Після цього з'ясуйте відомі величини, виписавши їх значення під формулою. Наприклад, якщо відомо, що pH дорівнює 10,1, запишіть це число під pH у формулі. Перетворіть формулу.При цьому вам знадобляться знання зі шкільного курсу алгебри. Для обчислення концентрації за відомим значенням pH необхідно перетворити формулу так, щоб концентрація відокремлено стояла з будь-якої з двох сторін рівняння. Тобто необхідно, щоб по одну сторону знака рівності був вираз, що містить величину pH, а по іншу — концентрація гідроксонію. Спочатку помножте обидві частини рівняння на -1. Потім зведіть 10 в ступені, що стоять по обидві сторони отриманого рівності.
Перетворіть формулу.При цьому вам знадобляться знання зі шкільного курсу алгебри. Для обчислення концентрації за відомим значенням pH необхідно перетворити формулу так, щоб концентрація відокремлено стояла з будь-якої з двох сторін рівняння. Тобто необхідно, щоб по одну сторону знака рівності був вираз, що містить величину pH, а по іншу — концентрація гідроксонію. Спочатку помножте обидві частини рівняння на -1. Потім зведіть 10 в ступені, що стоять по обидві сторони отриманого рівності.- Перетворюючи рівність pH = - log[H3O+], отримуємо формулу +[H3O+] = 10-pH, тобто концентрація іонів дорівнює десяти в ступені-pH. Тепер замість pH підставляємо відоме значення, в нашому випадку 10,1.
 Вирішіть рівняння.для зведення десяти в ступінь в калькуляторі передбачена певна процедура. Спочатку наберіть 10. Потім натисніть клавішу "EXP". Введіть знак мінуса і значення ступеня. Натиснути «=».
Вирішіть рівняння.для зведення десяти в ступінь в калькуляторі передбачена певна процедура. Спочатку наберіть 10. Потім натисніть клавішу "EXP". Введіть знак мінуса і значення ступеня. Натиснути «=».- У нашому прикладі pH дорівнює 10,1. Наберіть «10»і натисніть клавішу "EXP". Після цього натисніть" -/+", змінюючи знак. І нарешті, введіть значення pH «10,1"і натисніть клавішу"=". В результаті у вас повинно вийти 1E-100. Це означає, що концентрація становить 1,00 x 10-100 M.
 Обміркуйте отриману відповідь.чи має він фізичний сенс? Якщо pH дорівнює 10,1, це означає, що концентрація гідроксонію надзвичайно мала, і у вас лужний розчин.[12] таким чином, знайдена дуже низька концентрація відповідає
Обміркуйте отриману відповідь.чи має він фізичний сенс? Якщо pH дорівнює 10,1, це означає, що концентрація гідроксонію надзвичайно мала, і у вас лужний розчин.[12] таким чином, знайдена дуже низька концентрація відповідає
Поради
- Якщо обчислення рівня pH спочатку здається вам важким, не забувайте, що існує безліч джерел, що дозволяють більше дізнатися про це питання. Скористайтеся підручником хімії або попросіть викладача допомогти вам.
Джерела
- ↑ Http://academic.brooklyn.cuny.edu/biology/bio4fv/page/ph_def.htm
- ↑ Http://academic.brooklyn.cuny.edu/biology/bio4fv/page/ph_def.htm
- ↑ Http://academic.brooklyn.cuny.edu/biology/bio4fv/page/ph_def.htm
- ↑ Http://academic.brooklyn.cuny.edu/biology/bio4fv/page/ph_def.htm
- ↑ Https://www.mathsisfun.com/algebra/logarithms.html
- ↑ Http://www.gcsescience.com/m28.htm
- ↑ Http://chemed.chem.purdue.edu/genchem/topicreview/bp/ch17/ph.php
- ↑ Http://chemed.chem.purdue.edu/genchem/topicreview/bp/ch17/ph.php
- ↑ Http://www.chemteam.info/AcidBase/pH.html