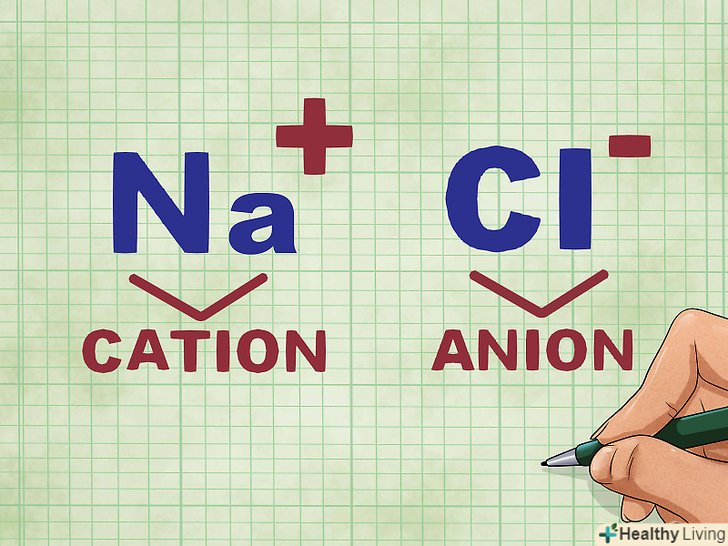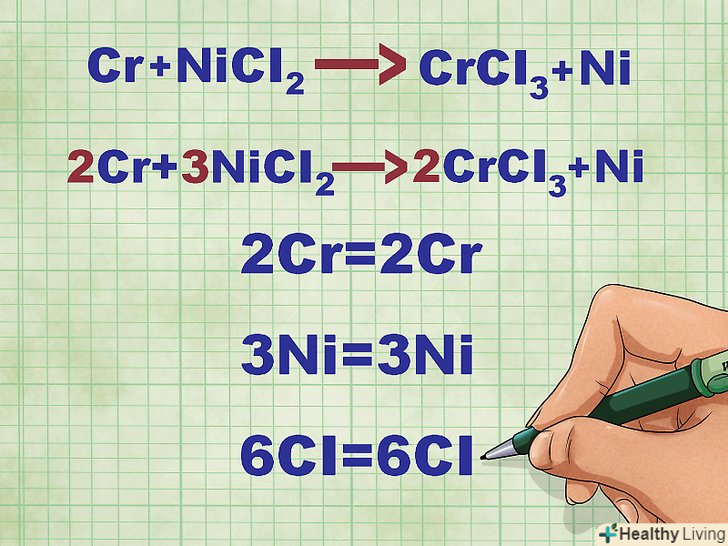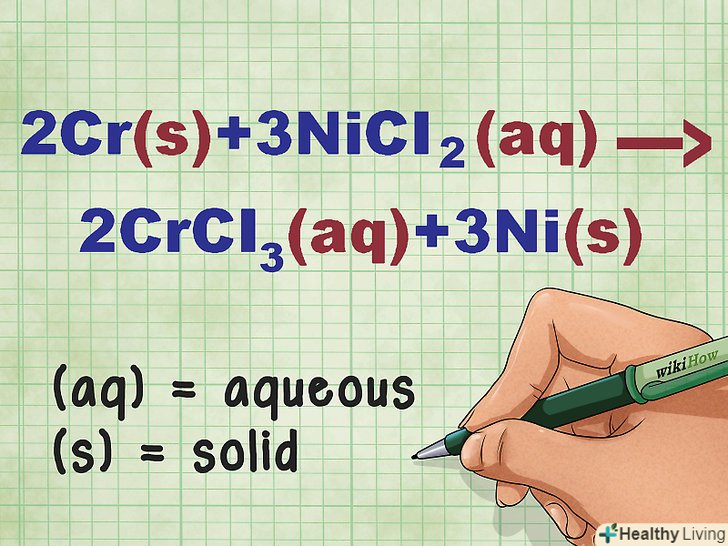Іонні рівняння є невід'ємною частиною хімії. У них представлені лише ті компоненти, які змінюються в ході хімічної реакції. Найчастіше іонні рівняння використовують для опису окислювально-відновних реакцій, реакцій обміну і нейтралізації.[1] щоб записати іонне рівняння, необхідно виконати три основні кроки: збалансувати молекулярне рівняння хімічної реакції, перевести його в повне іонне рівняння (тобто записати компоненти в тому вигляді, в якому вони існують в розчині) і, нарешті, записати короткий іонне рівняння.
Кроки
Частина1 З 2:
Компоненти іонного рівняння
Частина1 З 2:
 Зрозумійте різницю між молекулярними іІонними сполуками.для запису іонного рівняння насамперед слід визначити беруть участь в реакції іонні сполуки. Іонними називають ті речовини, які у водних розчинах дисоціюють (розпадаються) на заряджені іони.[2] молекулярні сполуки не розпадаються на іони. Вони складаються з двох неметалевих елементів, і іноді їх називають ковалентними сполуками.[3]
Зрозумійте різницю між молекулярними іІонними сполуками.для запису іонного рівняння насамперед слід визначити беруть участь в реакції іонні сполуки. Іонними називають ті речовини, які у водних розчинах дисоціюють (розпадаються) на заряджені іони.[2] молекулярні сполуки не розпадаються на іони. Вони складаються з двох неметалевих елементів, і іноді їх називають ковалентними сполуками.[3]- Іонні сполуки можуть виникати між металом і неметалом, металом і багатоатомними іонами, або між декількома багатоатомними іонами.
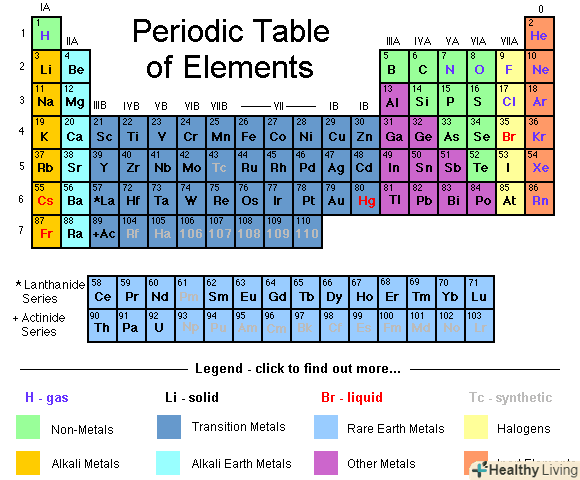
- Якщо ви сумніваєтеся, до якої групи належить те чи інше з'єднання, подивіться на властивості складових його елементів втаблиці Менделєєва.[4]
 Визначте розчинність сполуки.не всі іонні сполуки розчиняються у водних розчинах, тобто не всі з них дисоціюють на окремі іони. Перш ніж приступити до запису рівняння, слід знайти розчинність кожного з'єднання. Нижче наведені короткі правила розчинності. Більш докладні відомості і виключення з правил можна знайти в таблиці розчинності.[5]
Визначте розчинність сполуки.не всі іонні сполуки розчиняються у водних розчинах, тобто не всі з них дисоціюють на окремі іони. Перш ніж приступити до запису рівняння, слід знайти розчинність кожного з'єднання. Нижче наведені короткі правила розчинності. Більш докладні відомості і виключення з правил можна знайти в таблиці розчинності.[5]- Дотримуйтесь правил в тому порядку, в якому вони наведені нижче:
- Всі солі Na+, K+ і NH4+ розчиняються;
- Всі солі NO 3 - , c2H3O2 - , ClO3- і ClO4- розчинні;
- Всі солі Ag + , Pb2+ і Hg22 + нерозчинні;
- Всі солі Cl-, Br- і I - розчиняються;
- Солі CO32-, O2-, S2-, OH-, PO43-, CrO42-, Cr2O72- і so32- нерозчинні (за деякими винятками);
- Солі so42- розчинні (за деякими винятками).
 Визначте катіон і аніон з'єднання.катіонами називають позитивно заряджені іони (зазвичай це метали). Аніони мають негативний заряд, як правило це іони неметалів. Деякі неметали можуть утворювати не тільки аніони, але і катіони, в той час як атоми металів завжди виступають в ролі катіонів.[6]
Визначте катіон і аніон з'єднання.катіонами називають позитивно заряджені іони (зазвичай це метали). Аніони мають негативний заряд, як правило це іони неметалів. Деякі неметали можуть утворювати не тільки аніони, але і катіони, в той час як атоми металів завжди виступають в ролі катіонів.[6]- Наприклад, в з'єднанні NaCl (кухонна сіль) Na є позитивно зарядженим катіоном, оскільки це метал, а Cl являє собою негативно заряджений аніон, так як це неметал.
 Визначте беруть участь в реакції багатоатомні (складні) іони.такі іони являють собою заряджені молекули, між атомами яких існує така сильна зв'язок, що вони не дисоціюють при хімічних реакціях.[7] необхідно виявити багатоатомні іони, оскільки вони володіють своїм зарядом і не розпадаються на окремі атоми. Багатоатомні іони можуть мати як позитивний, так і негативний заряд.
Визначте беруть участь в реакції багатоатомні (складні) іони.такі іони являють собою заряджені молекули, між атомами яких існує така сильна зв'язок, що вони не дисоціюють при хімічних реакціях.[7] необхідно виявити багатоатомні іони, оскільки вони володіють своїм зарядом і не розпадаються на окремі атоми. Багатоатомні іони можуть мати як позитивний, так і негативний заряд.- При вивченні загального курсу хімії вам, швидше за все, знадобиться запам'ятати деякі з найбільш поширених багатоатомних іонів.
- До найбільш поширених багатоатомних іонів відносяться CO32-, NO3-, NO2-, SO42-, SO32-, CLO4- і CLO3-.[8]
- Існує безліч інших багатоатомних іонів, які можна знайти в підручнику хімії або інтернеті.[9]
Частина2 З 2:
Запис іонних рівнянь
Частина2 З 2:
 Збалансуйте повне молекулярне рівняння. перш ніж приступити до запису іонного рівняння, слід збалансувати вихідне молекулярне рівняння. Для цього необхідно розставити відповідні коефіцієнти перед сполуками, так щоб число атомів кожного елемента в лівій частині дорівнювало їх кількості в правій частині рівняння.
Збалансуйте повне молекулярне рівняння. перш ніж приступити до запису іонного рівняння, слід збалансувати вихідне молекулярне рівняння. Для цього необхідно розставити відповідні коефіцієнти перед сполуками, так щоб число атомів кожного елемента в лівій частині дорівнювало їх кількості в правій частині рівняння.- Запишіть число атомів кожного елемента по обидві сторони рівняння.
- Додайте перед елементами (крім кисню і водню) коефіцієнти, так щоб кількість атомів кожного елемента в лівій і правій частині рівняння було однаковим.
- Збалансуйте атоми водню.
- Збалансуйте атоми кисню.
- Перерахуйте кількість атомів кожного елемента по обидві сторони рівняння і переконайтеся, що воно однаково.
- Наприклад, після балансування рівняння Cr + NiCl2 --&#gt; CrCl3 + Ni отримуємо 2CR + 3nicl2 --&#gt; 2crcl3 + 3ni.
 Визначте, в якому стані знаходиться кожна речовина, яка бере участь в реакції.часто про це можна судити за умовою завдання. Є певні правила, які допомагають визначити, в якому стані знаходиться елемент або з'єднання.[10]
Визначте, в якому стані знаходиться кожна речовина, яка бере участь в реакції.часто про це можна судити за умовою завдання. Є певні правила, які допомагають визначити, в якому стані знаходиться елемент або з'єднання.[10]- Якщо в умові завдання не вказано стан того чи іншого елемента, використовуйте для його визначення таблицю Менделєєва.
- Якщо в умові сказано, що з'єднання знаходиться в розчині, відзначте це (р-р).
- Якщо в рівняння входить вода, визначте по таблиці розчинності, дисоціює чи дане іонне з'єднання.[11] у разі високої розчинності з'єднання дисоціює у воді (р-р). Якщо з'єднання має низьку розчинність, воно залишиться в твердому вигляді (тв).
- Якщо в реакції не бере участь вода, іонне з'єднання залишиться в твердому вигляді (тв).
- Якщо в задачі фігурує кислота або підстава, вони будуть розчинені у воді (р-р).
- Як приклад розглянемо реакцію 2CR + 3nicl2 --&#gt; 2crcl3 + 3ni. У чистому вигляді елементи Cr і Ni знаходяться у твердій фазі. NiCl2 і CrCl3 являють собою розчинні іонні сполуки, тобто вони знаходяться в розчині. Таким чином, дане рівняння можна переписати в наступному вигляді: 2CR(тв) + 3nicl2(р-р) --&#gt; 2crcl3(р-р) + 3ni(тв).
 Визначте, які сполуки дисоціюють (поділяються на катіони і аніони) в розчині.при дисоціації з'єднання розпадається на позитивний (катіон) і негативний (аніон) компоненти. Ці компоненти потім увійдуть в іонне рівняння хімічної реакції.
Визначте, які сполуки дисоціюють (поділяються на катіони і аніони) в розчині.при дисоціації з'єднання розпадається на позитивний (катіон) і негативний (аніон) компоненти. Ці компоненти потім увійдуть в іонне рівняння хімічної реакції.- Не дисоціюють тверді тіла, рідини, гази, молекулярні сполуки, іонні сполуки з низькою розчинністю, багатоатомні іони і слабкі кислоти.
- Повністю дисоціюють іонні сполуки з високою розчинністю (використовуйте таблицю розчинності) і сильні кислоти (HCl(р-р), HBr(р-р), HI(р-р), H2SO4(р-р), HClO4(Р-Р) і HNO3(Р-Р)).[12]
- Врахуйте, що хоча багатоатомні іони не дисоціюють, вони можуть входити до складу іонного з'єднання і відокремитися від нього в розчині.
 Порахуйте заряд кожного дисоціювати іона.при цьому пам'ятайте, що метали утворюють позитивно заряджені катіони, а атоми неметалів перетворюються в негативні аніони. Визначте заряди елементів по таблиці Менделєєва. Необхідно також збалансувати всі заряди в нейтральних з'єднаннях.
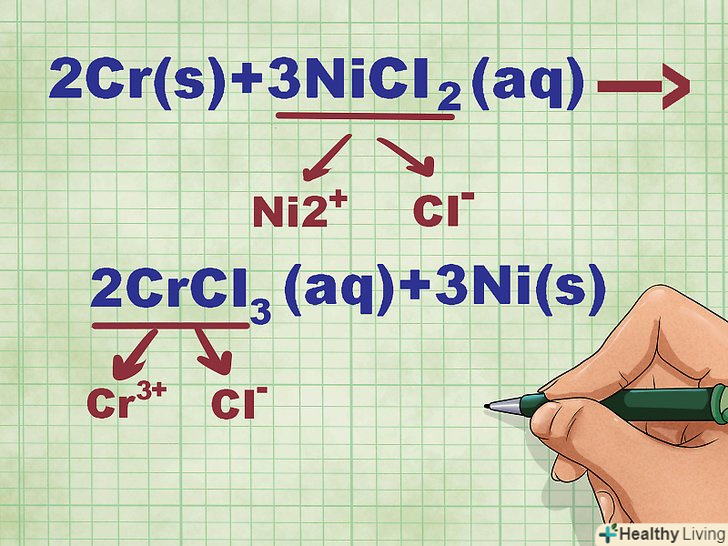
Порахуйте заряд кожного дисоціювати іона.при цьому пам'ятайте, що метали утворюють позитивно заряджені катіони, а атоми неметалів перетворюються в негативні аніони. Визначте заряди елементів по таблиці Менделєєва. Необхідно також збалансувати всі заряди в нейтральних з'єднаннях.- У наведеному вище прикладі NiCl2 дисоціює на Ni2+ і Cl-, а CrCl3 розпадається на Cr3+ і Cl-.
- Іон нікелю має заряд 2+ , оскільки він з'єднаний з двома іонами хлору, кожен з яких має одиничний негативний заряд і. При цьому один іон Ni повинен збалансувати два негативно заряджених іона Cl. Іон Cr має заряд 3+, так як він повинен нейтралізувати три негативно заряджених іона Cl.
- Пам'ятайте про те, що багатоатомні іони мають свої власні заряди.[13]
 Перепишіть рівняння так, щоб всі розчинні сполуки були розділені на окремі іони.все що дисоціює або іонізується (наприклад, сильні кислоти) розпадеться на два окремих іона. При цьому речовина залишиться в розчиненому стані (р-Р). Перевірте, щоб рівняння було збалансовано.
Перепишіть рівняння так, щоб всі розчинні сполуки були розділені на окремі іони.все що дисоціює або іонізується (наприклад, сильні кислоти) розпадеться на два окремих іона. При цьому речовина залишиться в розчиненому стані (р-Р). Перевірте, щоб рівняння було збалансовано.- Тверді речовини, рідини, гази, слабкі кислоти і іонні сполуки з низькою розчинністю не змінять свого стану і не розділяться на іони. Залиште їх в колишньому вигляді.
- Молекулярні сполуки просто розсіються в розчині, і їх стан зміниться на розчинене (р-р). Є три молекулярних сполуки, якіне перейдуть в стан (р-р), це CH4 (г), C3H8 (г) і C8H18 (ж) .
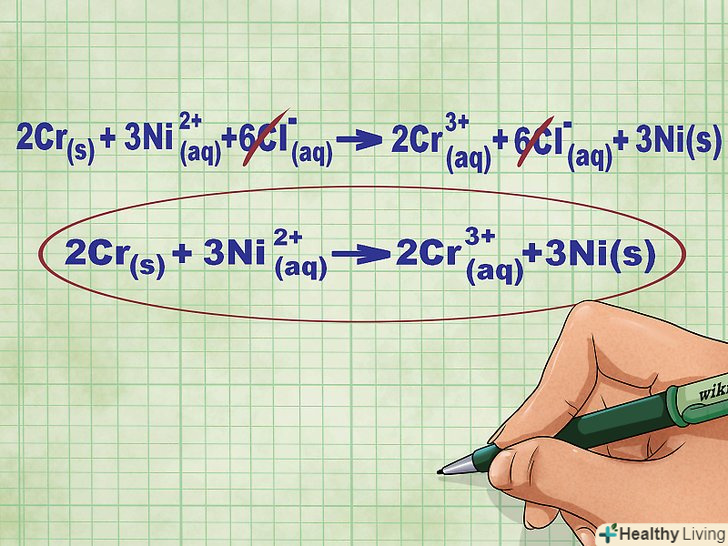
- Для даної реакції повне іонне рівняння запишеться в наступному вигляді: 2CR(тв) + 3Ni2+(р-р) + 6Cl-(р-р) --&#gt; 2CR3+(Р-Р) + 6cl-(Р-Р) + 3ni(ТВ). Якщо хлор не входить до складу сполуки, він розпадається на окремі атоми, тому ми помножили кількість іонів Cl на 6 з обох сторін рівняння.
 Скоротіть однакові іони в лівій і правій частині рівняння. можна викреслити лише ті іони, які повністю ідентичні з обох сторін рівняння (мають однакові заряди, нижні індекси і так далі). Перепишіть рівняння без цих іонів.
Скоротіть однакові іони в лівій і правій частині рівняння. можна викреслити лише ті іони, які повністю ідентичні з обох сторін рівняння (мають однакові заряди, нижні індекси і так далі). Перепишіть рівняння без цих іонів.- У нашому прикладі обидві частини рівняння містять 6 іонів Cl - , які можна викреслити. Таким чином, отримуємо коротке іонне рівняння: 2Cr(тв) + 3ni2+(р-р) --&#gt; 2CR3+(р-р) + 3ni(тв).
- Перевірте результат. Сумарні заряди лівої і правої частин іонного рівняння повинні бути рівні.
Поради
- Привчіть себе Завжди записувати агрегатний стан всіх компонентів у всіх рівняннях хімічних реакцій.
Джерела
- ↑ http://www.chemteam.info/Equations/Net-Ionic-Equation.html
- ↑ Http://www.chemteam.info/Equations/Net-Ionic-Equation.html
- ↑ http://www.chemteam.info/Equations/Net-Ionic-Equation.html
- ↑ Http://www.ptable.com/
- ↑ Http://chemistry.bd.psu.edu/jircitano/soluble.html
- ↑ Http://study.com/academy/lesson/cation-definition-examples-quiz.html
- ↑ Http://antoine.frostburg.edu/chem/senese/101/compounds/polyatomic.shtml
- ↑ Http://antoine.frostburg.edu/chem/senese/101/compounds/polyatomic.shtml
- ↑ Http://www.chemistry.wustl.edu/~edudev/LabTutorials/PeriodicProperties/Ions/ions.html
- ↑ Https://workspace.novacentral.ca/sites/home/pearson/Mr%20Melindys%20Documents/Science%201206/Chemistry/DeterminingStates.pdf
- ↑ Http://chemistry.bd.psu.edu/jircitano/soluble.html
- ↑ Http://www.chemteam.info/AcidBase/Strong-Weak-AcidBase.html
- ↑ Http://www.chemistry.wustl.edu/~edudev/LabTutorials/PeriodicProperties/Ions/ions.html