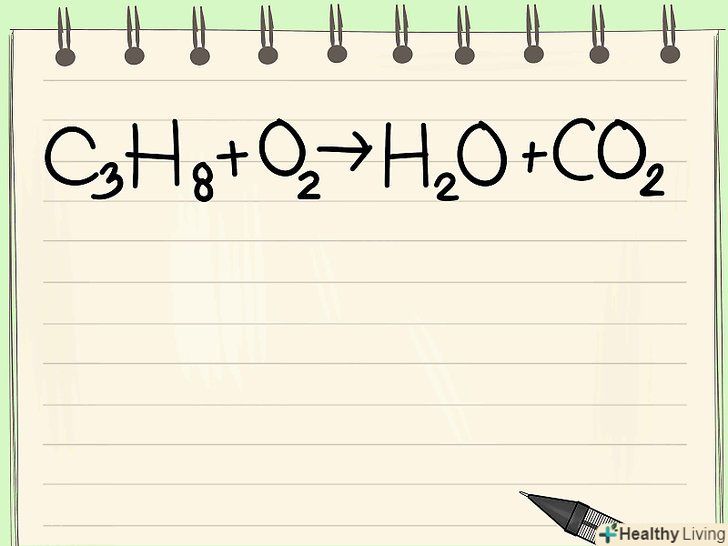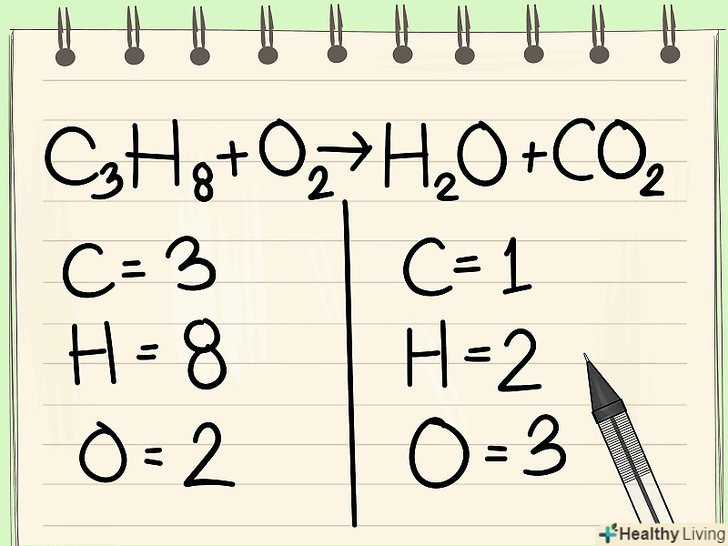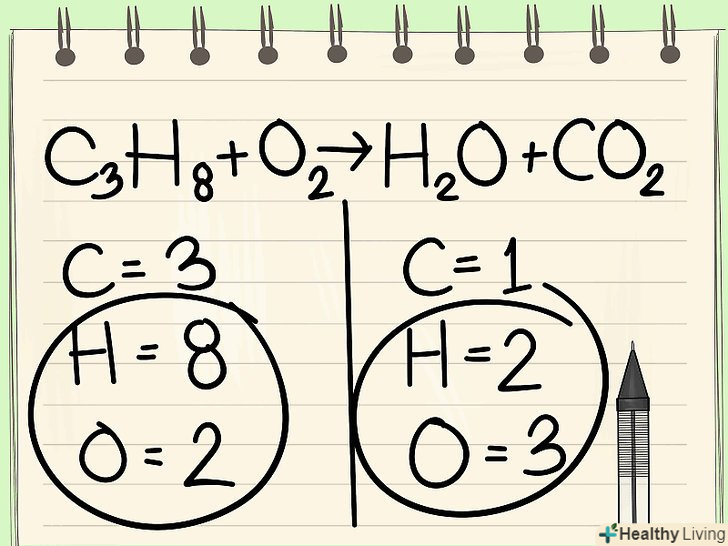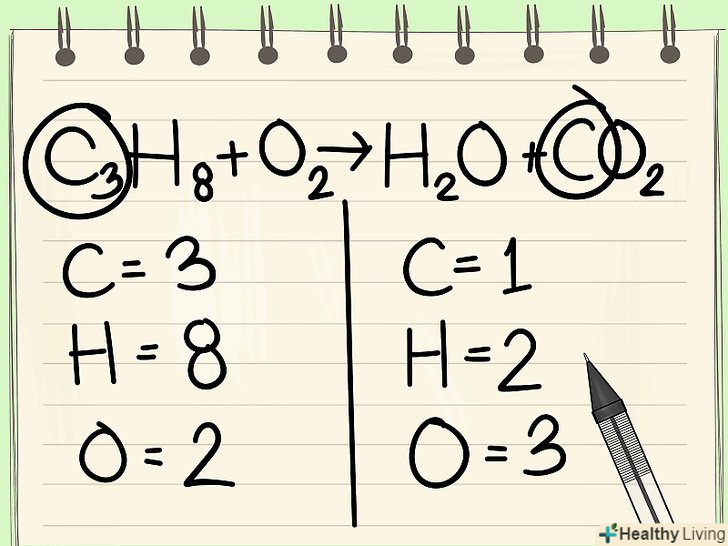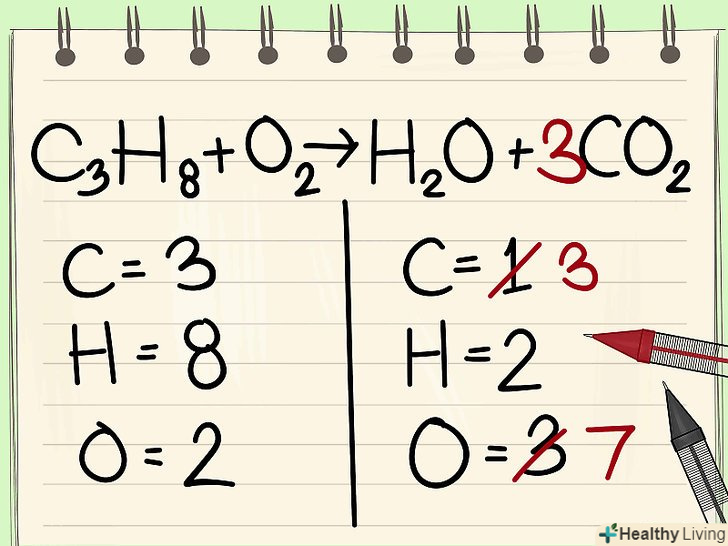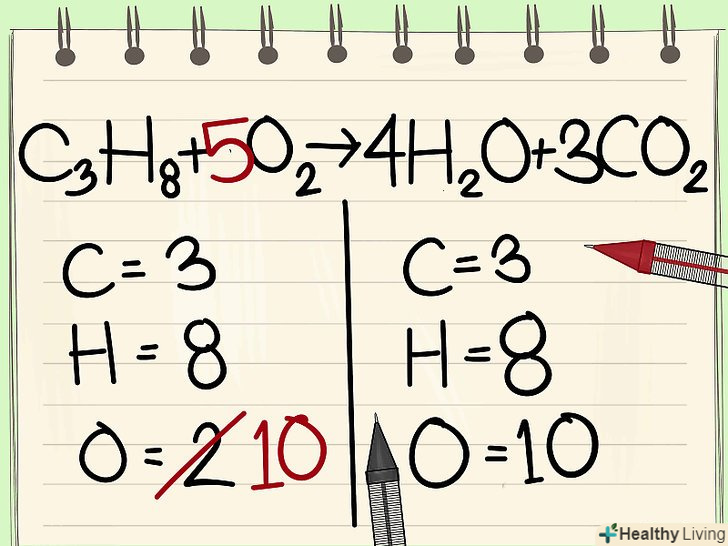Хімічне рівняння-це символічне представлення хімічної реакції. При цьому вступають в реакцію з'єднання (реагенти) пишуться в лівій, а отримані речовини (продукти реакції) — в правій частині рівняння. Між ними ставиться стрілка зліва направо, яка вказує напрямок реакції. Відповідно до закону збереження маси, в ході хімічної реакції не можуть з'явитися нові атоми або зникнути старі, тому кількість атомів в реагентах має дорівнювати числу атомів в продуктах хімічної реакції. У даній статті описано, як приводити хімічні рівняння до балансу за допомогою різних методів.[1]
Кроки
Метод1 З 2:
Традиційний метод
Метод1 З 2:
 Запишіть хімічне рівняння.як приклад розглянемо наступну реакцію:
Запишіть хімічне рівняння.як приклад розглянемо наступну реакцію:- C3H8 + O2 –&#gt; H2O + CO2
- Ця реакція описує горіння пропану (c3H8) в присутності кисню з утворенням води і діоксиду вуглецю (вуглекислого газу).
 Запишіть кількість атомів кожного елемента.зробіть це для обох частин рівняння. Зверніть увагу на підрядкові індекси біля кожного елемента, щоб визначити загальну кількість атомів. Запишіть символ кожного входить в рівняння елемента і відзначте відповідну кількість атомів.[2]
Запишіть кількість атомів кожного елемента.зробіть це для обох частин рівняння. Зверніть увагу на підрядкові індекси біля кожного елемента, щоб визначити загальну кількість атомів. Запишіть символ кожного входить в рівняння елемента і відзначте відповідну кількість атомів.[2]- Наприклад, в правій частині розглянутого рівняння в результаті складання отримуємо 3 атома кисню.
- У лівій частині маємо 3 атома вуглецю (c3), 8 атомів водню (H8) і 2 атома кисню (O2).
- У правій частині маємо 1 атом вуглецю (C), 2 атома водню (H2) і 3 атома кисню (O + O2).
 Залиште водень і кисень на потім, так як вони входять до складу декількох з'єднань в лівій і правій частині.водень і кисень входять до складу декількох молекул, тому краще збалансувати їх в останню чергу.[3]
Залиште водень і кисень на потім, так як вони входять до складу декількох з'єднань в лівій і правій частині.водень і кисень входять до складу декількох молекул, тому краще збалансувати їх в останню чергу.[3]- Перш ніж балансувати водень і кисень, доведеться ще раз перерахувати атоми, так як можуть знадобитися додаткові коефіцієнти, щоб збалансувати інші елементи.
 Почніть з найменш часто зустрічається елемента.якщо необхідно збалансувати кілька елементів, виберіть такий, який входить до складу однієї молекули реагентів і однієї молекули продуктів реакції. Таким чином, спочатку слід збалансувати вуглець.[4]
Почніть з найменш часто зустрічається елемента.якщо необхідно збалансувати кілька елементів, виберіть такий, який входить до складу однієї молекули реагентів і однієї молекули продуктів реакції. Таким чином, спочатку слід збалансувати вуглець.[4] Для балансу додайте коефіцієнт перед єдиним атомом вуглецю. поставте коефіцієнт перед єдиним атомом вуглецю в правій частині рівняння, щоб збалансувати його з 3 атомами вуглецю в лівій частині.[5]
Для балансу додайте коефіцієнт перед єдиним атомом вуглецю. поставте коефіцієнт перед єдиним атомом вуглецю в правій частині рівняння, щоб збалансувати його з 3 атомами вуглецю в лівій частині.[5]- C3H8 + O2 –&#gt; H2O + 3CO2
- Коефіцієнт 3 перед вуглецем в правій частині рівняння вказує на те, що виходить три атоми вуглецю, які відповідають трьома атомам вуглецю, що входять в молекулу пропану в лівій частині.
- В хімічному рівнянні можна змінювати коефіцієнти перед атомами і молекулами, проте підрядкові індекси повинні залишатися незмінними.
 Після цього збалансуйте атоми водню.після того як ви зрівняли кількість атомів вуглецю в лівій і правій частині, незбалансованими залишилися водень і кисень. Ліва частина рівняння містить 8 атомів водню, стільки ж їх повинно бути і справа. Досягніть цього за допомогою коефіцієнта.[6]
Після цього збалансуйте атоми водню.після того як ви зрівняли кількість атомів вуглецю в лівій і правій частині, незбалансованими залишилися водень і кисень. Ліва частина рівняння містить 8 атомів водню, стільки ж їх повинно бути і справа. Досягніть цього за допомогою коефіцієнта.[6]- C3H8 + O2 –&#gt; 4H2O + 3CO2
- Ми додали коефіцієнт 4 у правій частині, оскільки Підрядковий індекс показує, що у нас вже є два атоми водню.
- Якщо помножити коефіцієнт 4 на Підрядковий індекс 2, вийде 8.
- В результаті в правій частині виходить 10 атомів кисню: 3x2=6 атомів в трьох молекулах 3co2 і ще чотири атоми в чотирьох молекулах води.
 Збалансуйте атоми кисню.не забудьте врахувати коефіцієнти, які ви використовували для балансування інших атомів. Оскільки ви додали коефіцієнти перед молекулами в правій частині рівняння, кількість атомів кисню змінилося. Тепер у вас є 4 атоми кисню в молекулах води та 6 атомів кисню в молекулах діоксиду вуглецю. Таким, чином, в праву частину входить 10 атомів кисню.[7]
Збалансуйте атоми кисню.не забудьте врахувати коефіцієнти, які ви використовували для балансування інших атомів. Оскільки ви додали коефіцієнти перед молекулами в правій частині рівняння, кількість атомів кисню змінилося. Тепер у вас є 4 атоми кисню в молекулах води та 6 атомів кисню в молекулах діоксиду вуглецю. Таким, чином, в праву частину входить 10 атомів кисню.[7]- Додайте коефіцієнт 5 до молекули кисню в лівій частині рівняння. Тепер кожна частина містить по 10 атомів кисню.
- C3H8 + 5O2 –&#gt; 4H2O + 3CO2.

- Отже, обидві частини рівняння містять однакову кількість атомів вуглецю, водню і кисню. Рівняння збалансоване.
Метод2 З 2:
Алгебраїчний метод
Метод2 З 2:
- Запишіть рівняння реакції.як приклад розглянемо наступну хімічну реакцію:
- PCl5 + H2O –&#gt; H3PO4 + HCl
- Поставте букву перед кожним з'єднанням:
- APCl5 + BH2O –&#gt; CH3PO4 + DHCl
- Прирівняйте кількість атомів кожного елемента в лівій і правій частинах рівняння. [8]
- APCl5 + BH2O –&#gt; CH3PO4 + DHCl
- Зліва маємо 2Bатомів водню (по 2 в кожній молекулі H2O), в той час як праворуч 3C+Dатомів водню (по 3 в кожній молекулі H3PO 4 і по 1 в кожній молекулі HCl). Оскільки ліва і права частина повинні містити однакове число атомів водню, 2Bмає дорівнювати 3C+ D.
- Зробіть це для всіх елементів:
- P:A=C
- Cl: 5A=D
- H: 2B=3C+D
- Вирішіть систему рівнянь, щоб знайти чисельні значення коефіцієнтів.система має кілька рішень, так як змінних більше, ніж рівнянь. Необхідно знайти таке рішення, щоб всі коефіцієнти мали вигляд мінімально можливих цілих чисел.[9]
- Щоб швидко вирішити систему рівнянь, присвоїмо чисельне значення однієї зі змінних. Припустимо, a=1. Вирішимо систему і знайдемо значення інших змінних:
- Для P a = c, тому c = 1
- Для Cl 5a = d, тому d = 5
- Оскільки для H 2B = 3C + d, знаходимо величину b:
- 2b = 3(1) + 5
- 2b = 3 + 5
- 2b = 8
- B=4
- Таким чином, маємо такі коефіцієнти:
- A = 1
- B = 4
- C = 1
- D = 5
Поради
- Якщо ви відчуваєте труднощі, для балансування рівнянь хімічних реакцій можна використовувати онлайн-калькулятор. Однак врахуйте, що таким калькулятором не дозволяється користуватися під час іспиту, тому не покладайтеся лише на нього.
- Пам'ятайте, що іноді рівняння можна спростити! Якщо всі коефіцієнти діляться без залишку на ціле число, спростіть рівняння.
Попередження
- Щоб позбутися від дробових коефіцієнтів, помножте все рівняння (його ліву і праву частину) на знаменник дробу.
- Ніколи не використовуйте в якості коефіцієнтів хімічного рівняння дробу-в хімічних реакціях не буває половин молекул або атомів.
- В процесі балансування для зручності можна використовувати дроби, проте рівняння не збалансовано до тих пір, поки в ньому залишаються дробові коефіцієнти.
Джерела
- ↑ Http://www.middleschoolchemistry.com/lessonplans/chapter6/lesson1
- ↑ Https://sciencing.com/number-atoms-element-5907807.html
- ↑ Http://www.sky-web.net/science/balancing_chemical_equations.htm
- ↑ Https://opentextbc.ca/introductorychemistry/chapter/the-chemical-equation-2/
- ↑ Https://opentextbc.ca/chemistry/chapter/4-1-writing-and-balancing-chemical-equations/
- ↑ Http://chemed.chem.purdue.edu/genchem/topicreview/bp/ch3/equations.html
- ↑ Https://www.bbc.com/bitesize/guides/zs3297h/revision/1
- ↑ Http://www.chembuddy.com/?left=balancing-stoichiometry&#amp;right=algebraic-method
- ↑ Http://www.nyu.edu/classes/tuckerman/adv.chem/lectures/lecture_2/node3.html