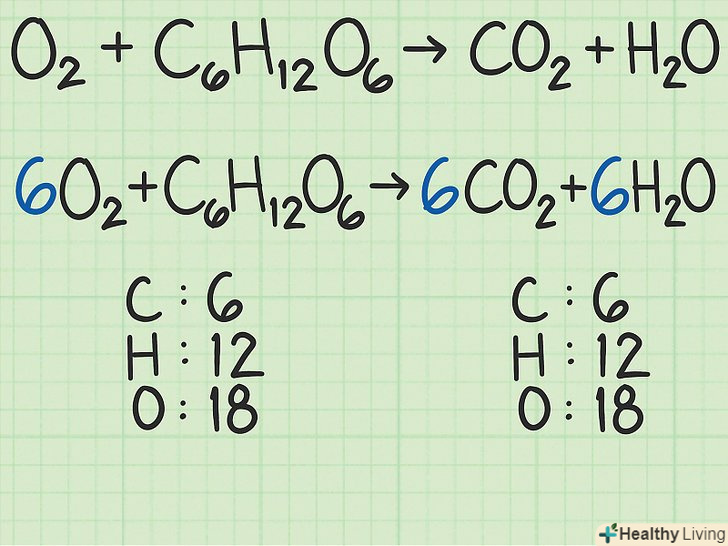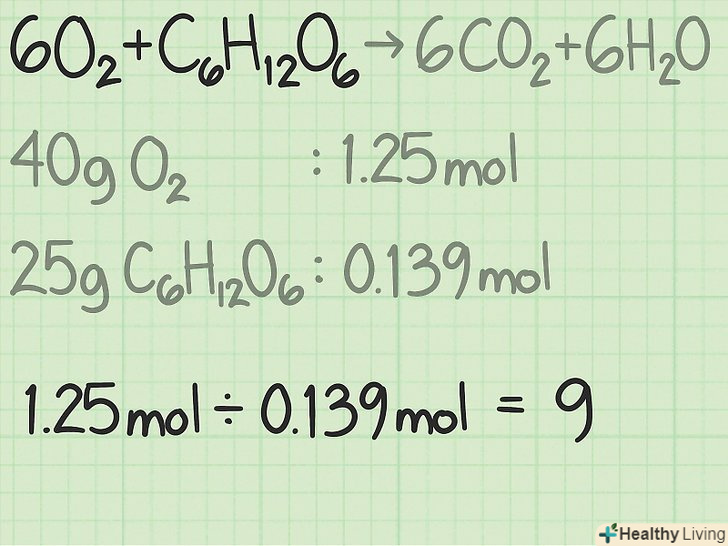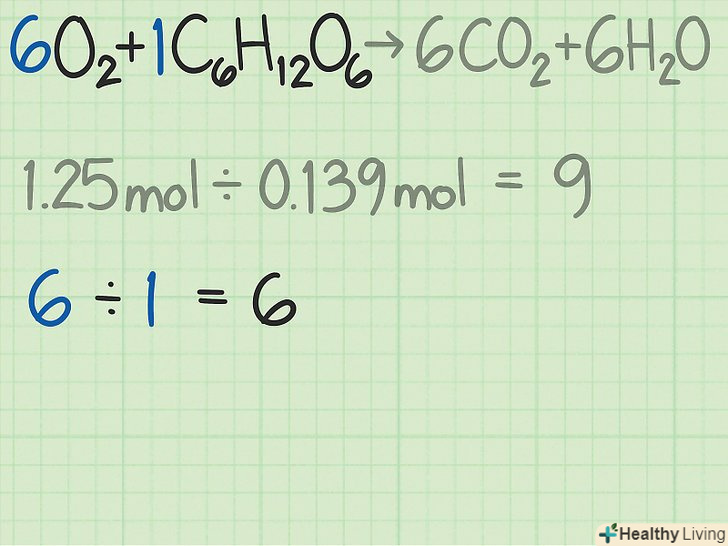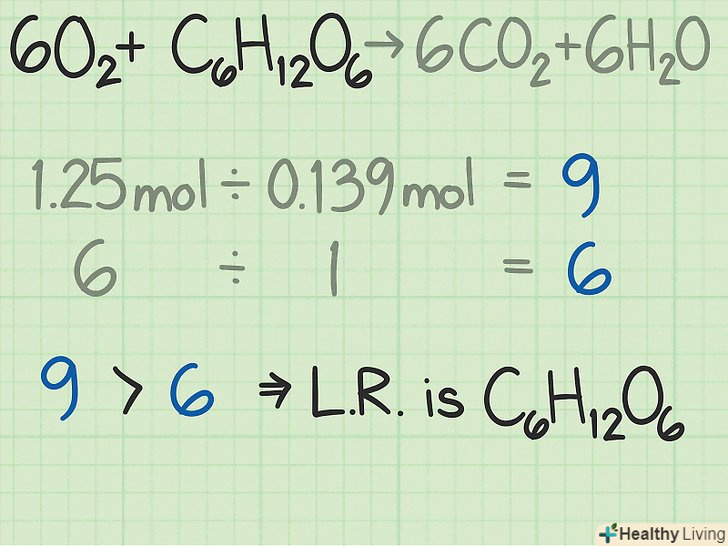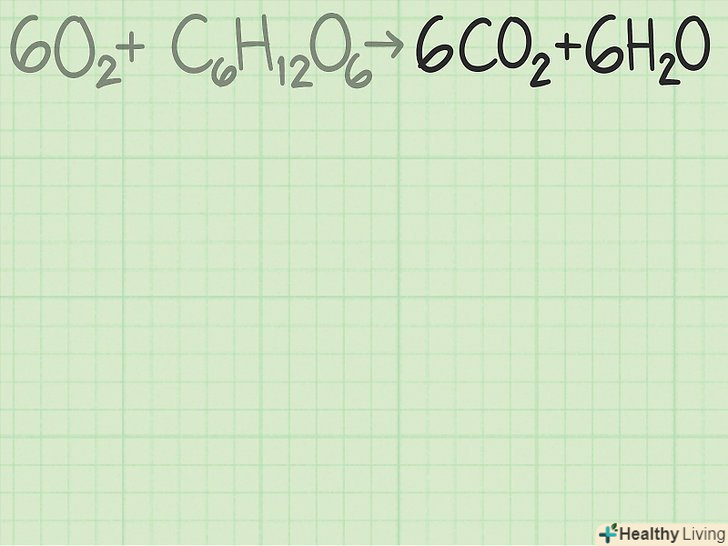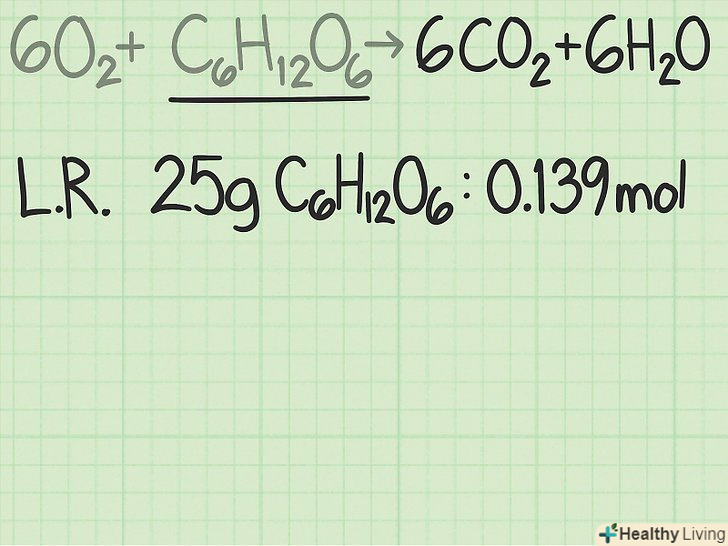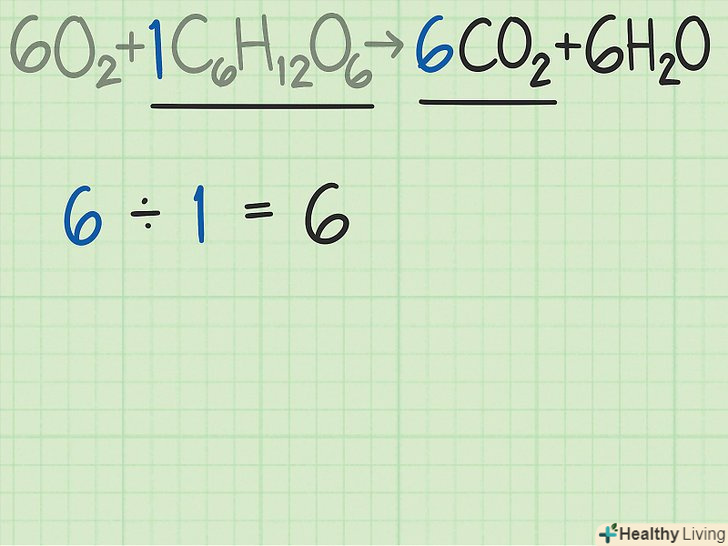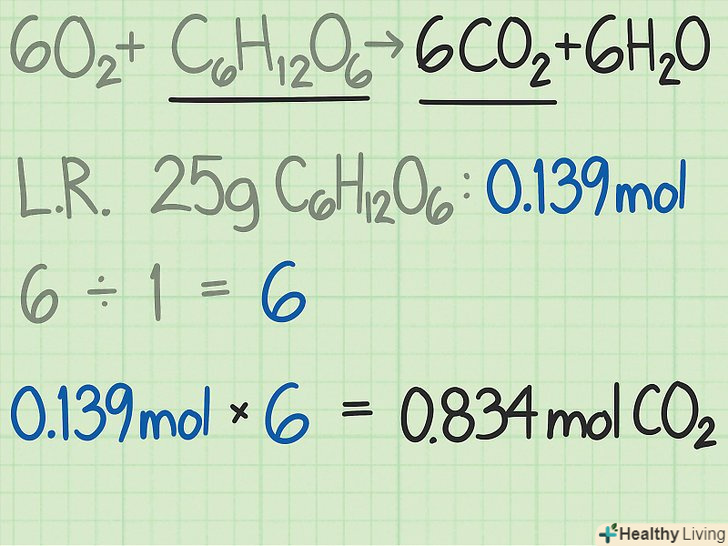В хімії термін "теоретичний вихід" використовується для опису максимальної кількості продукту, яке може вийти в результаті хімічної реакції. Спочатку слід записати збалансоване хімічне рівняння і визначити ключовий компонент реакції. Після того як ви виміряєте кількість цього компонента, можна буде розрахувати кількість продукту реакції. Це і буде теоретичний вихід продукту реакції. У реальних експериментах частина продукту зазвичай втрачається через неідеальні умови.
Кроки
Частина1 З 2:
Знайдіть ключовий компонент реакції
Частина1 З 2:
 Почніть зі збалансованого рівняння хімічної реакції.рівняння реакції подібно рецепту. З лівого боку в ньому наведені реагенти, а з правого — продукти реакції. В правильно збалансованому рівнянні хімічної реакції зліва і справа стоїть однакове число атомів кожного елемента.[1]
Почніть зі збалансованого рівняння хімічної реакції.рівняння реакції подібно рецепту. З лівого боку в ньому наведені реагенти, а з правого — продукти реакції. В правильно збалансованому рівнянні хімічної реакції зліва і справа стоїть однакове число атомів кожного елемента.[1]- Як приклад розглянемо просте рівняння
→
. Зліва і справа стоїть по два атома водню. Однак з боку реагентів знаходяться два атоми кисню, і лише один атом кисню представлений у вигляді продукту реакції.
- Щоб збалансувати рівняння, помножимо на два продукт реакції:
→
.
- Перевіримо баланс. Тепер у нас правильна кількість атомів кисню, по два атоми з кожного боку. Однак на цей раз ми маємо два атоми водню зліва і чотири атома водню справа.
- Помножимо на два водень в частині реагентів. В результаті у нас вийде
→
. Тепер ми маємо по чотири атоми водню і по два атоми кисню з кожної сторони рівняння. Таким чином, рівняння збалансоване.
- В якості більш складного прикладу розглянемо реакцію кисню і глюкози з утворенням вуглекислого газу і води:
→
. У цьому рівнянні з кожної сторони стоїть 6 атомів вуглецю (C), 12 атомів водню (H) і 18 атомів кисню (O). Рівняння збалансоване.
- Щоб дізнатися більш детально, як балансувати хімічні рівняння, прочитайте цю статтю.
- Як приклад розглянемо просте рівняння
 Розрахуйте молярні маси реагентів.за допомогою таблиці Менделєєва або довідника визначте молярні маси атомів всіх елементів, які входять в беруть участь в реакції з'єднання. Складіть їх, щоб визначити молярну масу кожного реагенту. Виконайте це для однієї молекули з'єднання. Розглянемо ще раз реакцію між киснем і глюкозою з утворенням вуглекислого газу і води:
Розрахуйте молярні маси реагентів.за допомогою таблиці Менделєєва або довідника визначте молярні маси атомів всіх елементів, які входять в беруть участь в реакції з'єднання. Складіть їх, щоб визначити молярну масу кожного реагенту. Виконайте це для однієї молекули з'єднання. Розглянемо ще раз реакцію між киснем і глюкозою з утворенням вуглекислого газу і води:→
.[2]
- У цьому прикладі одна молекула кисню (
) містить два атоми кисню.
- Молярна маса одного атома кисню становить близько 16 г/моль. При необхідності можна знайти більш точне значення.
- 2 атома кисню x 16 г/моль на атом = 32 г / моль
.
- Другий реагент, глюкоза (
), має молярну масу (6 атомів c x 12 г C/моль) + (12 атомів H x 1 г H/моль) + (6 атомів O x 16 г O/моль) = 180 г/моль.
- Більш детально цей крок описаний у статтіпорахувати молярну масу.
- У цьому прикладі одна молекула кисню (
 Переведіть кількість кожного реагенту з грамів в молі.у реальному експерименті відомі маси реагентів в грамах. Щоб перевести їх в кількість молей, поділіть масу кожного реагенту на його молярну масу.[3]
Переведіть кількість кожного реагенту з грамів в молі.у реальному експерименті відомі маси реагентів в грамах. Щоб перевести їх в кількість молей, поділіть масу кожного реагенту на його молярну масу.[3]- Припустимо, в реакцію вступають 40 грамів кисню і 25 грамів глюкози.
- 40 г
/ (32 г/моль) = 1,25 моля кисню.
- 25 г
/ (180 г/моль) = приблизно 0,139 моля глюкози.
 Визначте співвідношення реагентів.Моль використовується в хімії для того, щоб по масі речовини визначити кількість його молекул. Визначивши кількість молей кисню і глюкози, ви дізнаєтеся, скільки молекул кожної речовини вступає в реакцію. Щоб знайти співвідношення між двома реагентами, поділіть число молей одного реагенту на кількість молей іншого реагенту.[4]
Визначте співвідношення реагентів.Моль використовується в хімії для того, щоб по масі речовини визначити кількість його молекул. Визначивши кількість молей кисню і глюкози, ви дізнаєтеся, скільки молекул кожної речовини вступає в реакцію. Щоб знайти співвідношення між двома реагентами, поділіть число молей одного реагенту на кількість молей іншого реагенту.[4]- У розглянутому прикладі на початку реакції є 1,25 моля кисню і 0,139 моля глюкози. Таким чином, відношення кількості молекул кисню до числа молекул глюкози становить 1,25 / 0,139 = 9,0. Це означає, що молекул кисню в 9 разів більше, ніж молекул глюкози.
 Знайдіть стехіометричне співвідношення реагентів.Подивіться на збалансоване рівняння хімічної реакції. Коефіцієнти перед кожною молекулою показують відносну кількість даного виду молекул, необхідне для протікання реакції. Рівняння хімічної реакції дає так зване стехіометричне співвідношення реагентів, при якому вони будуть витрачатися повністю.[5]
Знайдіть стехіометричне співвідношення реагентів.Подивіться на збалансоване рівняння хімічної реакції. Коефіцієнти перед кожною молекулою показують відносну кількість даного виду молекул, необхідне для протікання реакції. Рівняння хімічної реакції дає так зване стехіометричне співвідношення реагентів, при якому вони будуть витрачатися повністю.[5]- Для даної реакції маємо
. Коефіцієнти вказують на те, що на кожну молекулу глюкози потрібно 6 молекул кисню. Таким чином, стехіометричне співвідношення для цієї реакції становить 6 молекул кисню / 1 молекула глюкози = 6,0.
- Для даної реакції маємо
 Порівняйте співвідношення, щоб знайти ключовий компонент реакції.у більшості хімічних реакцій один з реагентів витрачається раніше за інших. Цей реагент називають ключовим компонентом реакції. Він визначає, як довго триватиме дана реакція і яким буде теоретичний вихід продукту реакції. Порівняйте два розрахованих співвідношення, щоб визначити ключовий компонент реакції:[6]
Порівняйте співвідношення, щоб знайти ключовий компонент реакції.у більшості хімічних реакцій один з реагентів витрачається раніше за інших. Цей реагент називають ключовим компонентом реакції. Він визначає, як довго триватиме дана реакція і яким буде теоретичний вихід продукту реакції. Порівняйте два розрахованих співвідношення, щоб визначити ключовий компонент реакції:[6]- У розглянутому прикладі початкова кількість молей кисню в 9 разів перевищує число молей глюкози. Згідно з рівнянням, стехіометричне відношення кисню до глюкози становить 6:1. Отже, у нас є більше кисню, ніж потрібно, тому другий реагент, глюкоза, є ключовим компонентом реакції.
Частина2 З 2:
Визначте теоретичний вихід реакції
Частина2 З 2:
 Подивіться на рівняння і визначте очікуваний продукт реакції. права частина рівняння містить продукти реакції. Якщо рівняння збалансоване, коефіцієнти перед кожним продуктом реакції показують його відносну кількість в молях. Вони відповідають теоретичному виходу продуктів реакції в тому випадку, якщо взяти стехіометричне співвідношення реагентів.[7]
Подивіться на рівняння і визначте очікуваний продукт реакції. права частина рівняння містить продукти реакції. Якщо рівняння збалансоване, коефіцієнти перед кожним продуктом реакції показують його відносну кількість в молях. Вони відповідають теоретичному виходу продуктів реакції в тому випадку, якщо взяти стехіометричне співвідношення реагентів.[7]- Повернемося до наведеного вище прикладу:
→
. Праворуч стоять два продукти реакції: вуглекислий газ і вода.
- Щоб обчислити теоретичний вихід, можна почати з будь-якого продукту реакції. Буває так, що цікавий тільки певний продукт. В цьому випадку краще почати з нього.
- Повернемося до наведеного вище прикладу:
 Запишіть кількість молей ключового компонента реакції.завжди слід порівнювати число молей реагенту з кількістю молей продукту реакції. Порівняння їх мас не дасть правильного результату.[8]
Запишіть кількість молей ключового компонента реакції.завжди слід порівнювати число молей реагенту з кількістю молей продукту реакції. Порівняння їх мас не дасть правильного результату.[8]- У розглянутому прикладі ключовим компонентом реакції є глюкоза. Розрахунки молярної маси показали, що 25 грамів глюкози відповідають 0,139 моля.
 Порівняйте співвідношення молекул продукту і реагенту.поверніться до збалансованого рівняння і поділіть кількість молекул очікуваного продукту на число молекул ключового компонента реакції.
Порівняйте співвідношення молекул продукту і реагенту.поверніться до збалансованого рівняння і поділіть кількість молекул очікуваного продукту на число молекул ключового компонента реакції.- У нашому випадку збалансоване рівняння реакції має такий вигляд:
→
. Згідно з цим рівнянням, на 6 молекул очікуваного продукту реакції, вуглекислого газу (
), припадає 1 молекула глюкози (
).
- Відношення вуглекислого газу до глюкози становить 6/1 = 6. Іншими словами, в даній реакції з однієї молекули глюкози виходить 6 молекул вуглекислого газу.
- У нашому випадку збалансоване рівняння реакції має такий вигляд:
 Помножте знайдене відношення на кількість ключового компонента реакції в молях.в результаті ви отримаєте теоретичний вихід очікуваного продукту реакції в молях.
Помножте знайдене відношення на кількість ключового компонента реакції в молях.в результаті ви отримаєте теоретичний вихід очікуваного продукту реакції в молях.- У розглянутому прикладі 25 грамів глюкози відповідають 0,139 моля. Відношення вуглекислого газу до глюкози одно 6: 1. Тобто очікується, що з кожного Молю глюкози вийде шість молей вуглекислого газу.
- Теоретичний вихід вуглекислого газу становить (0,139 моля глюкози) x (6 молей вуглекислого газу / 1 моль глюкози) = 0,834 моля вуглекислого газу.
 Переведіть отриманий результат в грами.це назад тому, що ви робили, коли на самому початку обчислювали кількість молей реагенту. Якщо відомо очікуване число молей, досить помножити його на молярну масу продукту реакції, щоб отримати його теоретичний вихід в грамах.[9]
Переведіть отриманий результат в грами.це назад тому, що ви робили, коли на самому початку обчислювали кількість молей реагенту. Якщо відомо очікуване число молей, досить помножити його на молярну масу продукту реакції, щоб отримати його теоретичний вихід в грамах.[9]- У нашому прикладі молярна маса CO2 становить близько 44 г / моль (молярна маса вуглецю ~12 г / моль, кисню ~16 г / моль, в результаті маємо 12 + 16 + 16 = 44).
- Помножте 0,834 моля CO2 x 44 г/моль CO2 = ~36,7 грама. Таким чином, теоретичний вихід продукту реакції дорівнює 36,7 грама CO2.
 При бажанні виконайте такі ж обчислення для інших продуктів реакції.у багатьох експериментах інтерес представляє лише один продукт реакції. Однак якщо ви хочете знайти теоретичний вихід другого продукту, просто повторіть обчислення.
При бажанні виконайте такі ж обчислення для інших продуктів реакції.у багатьох експериментах інтерес представляє лише один продукт реакції. Однак якщо ви хочете знайти теоретичний вихід другого продукту, просто повторіть обчислення.- У нашому прикладі другим продуктом реакції є вода,
. Згідно збалансованому рівнянню реакції, з 6 молекул глюкози виходить 6 молекул води. Це відповідає співвідношенню 1: 1. Таким чином, якщо на початку реакції є 0,139 моля глюкози, в кінці повинно вийти 0,139 моля води.
- Помножте кількість молей води на її молярну масу. Молярна маса води становить 2 + 16 = 18 г/моль. В результаті отримуємо 0,139 моля H2O x 18 г/моль H2O = ~2,50 грама. Таким чином, в даному експерименті теоретичний вихід води складе 2,50 грама.
- У нашому прикладі другим продуктом реакції є вода,
Джерела
- ↑ Http://www.chemteam.info/Equations/Balance-Equation.html
- ↑ Https://www.boundless.com/chemistry/textbooks/boundless-chemistry-textbook/mass-relationships-and-chemical-equations-3/molar-mass-41/molar-mass-of-compounds-223-7524/
- ↑ Http://www.chemteam.info/Stoichiometry/Limiting-Reagent.html
- ↑ Http://www.chemteam.info/Equations/Balance-Equation.html
- ↑ Http://www.chemteam.info/Equations/Balance-Equation.html
- ↑ Https://www.khanacademy.org/science/chemistry/chemical-reactions-stoichiome/limiting-reagent-stoichiometry/a/limiting-reagents-and-percent-yield
- ↑ Http://www.chemteam.info/Equations/Balance-Equation.html
- ↑ Http://www.chemteam.info/Equations/Balance-Equation.html
- ↑ Https://www.boundless.com/chemistry/textbooks/boundless-chemistry-textbook/mass-relationships-and-chemical-equations-3/molar-mass-41/molar-mass-of-compounds-223-7524/