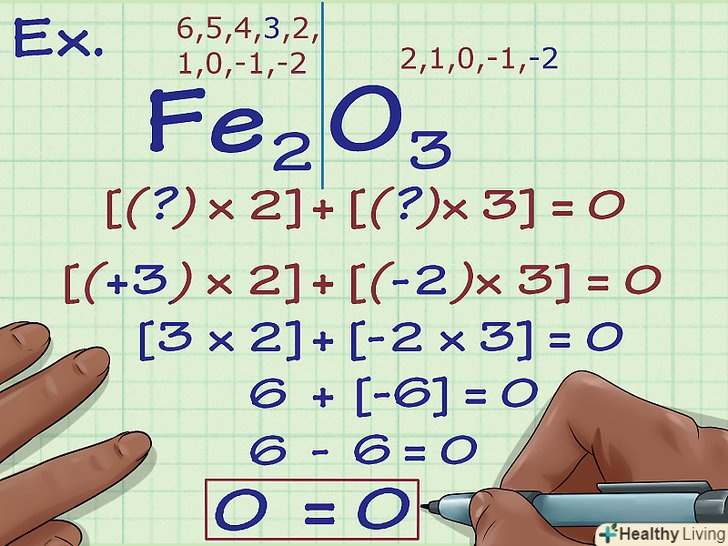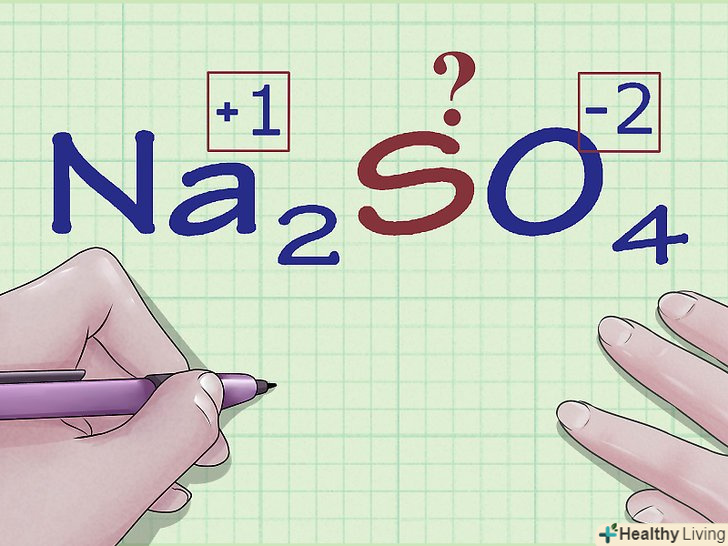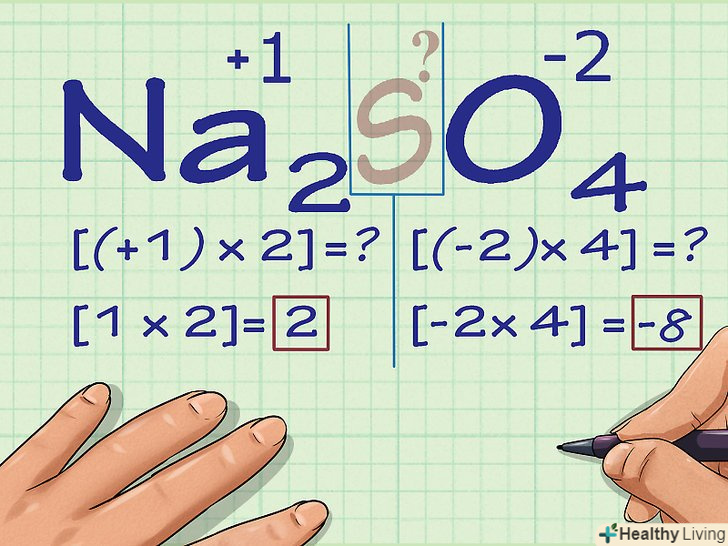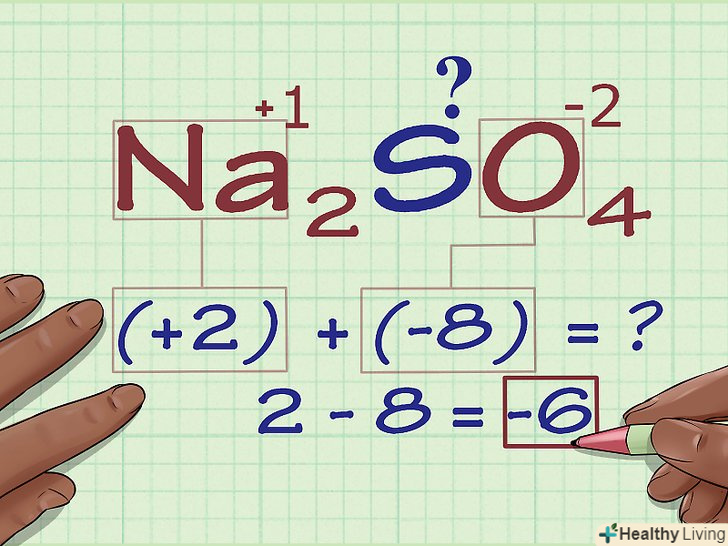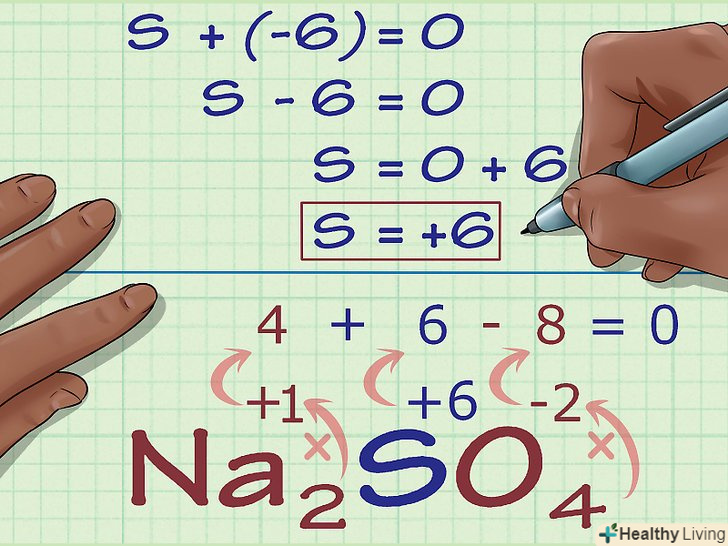В хімії терміни "окислення" і» відновлення " означає реакції, при яких атом або група атомів втрачають або, відповідно, набувають електрони. Ступінь окислення - це приписувана одному або декільком атомам чисельна величина, що характеризує кількість перерозподіляються електронів і показує, яким чином ці електрони розподіляються між атомами при реакції. Визначення цієї величини може бути як простий, так і досить складною процедурою, в залежності від атомів і складаються з них молекул. Більш того, атоми деяких елементів можуть володіти декількома ступенями окислення. На щастя, для визначення ступеня окислення існують нескладні однозначні правила, для впевненого користування якими досить знання основ хімії та алгебри.
Кроки
Частина1 З 2:
Визначення ступеня окислення за законами хімії
Частина1 З 2:
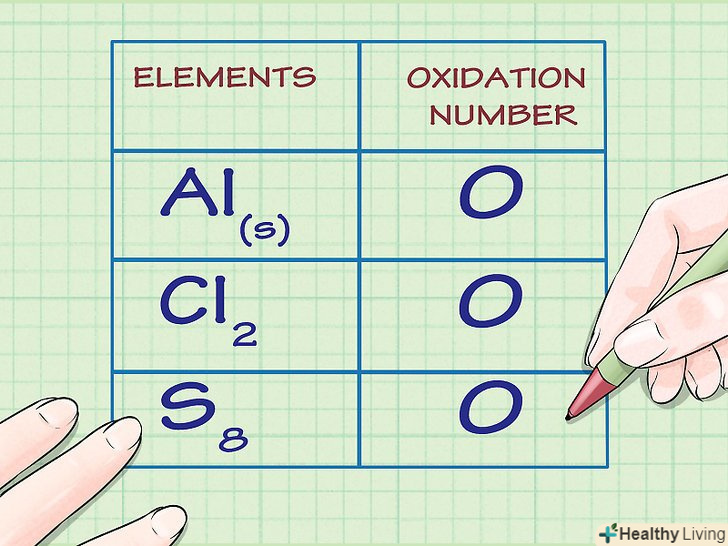
 Визначте, чи є розглядається речовина елементарним. ступінь окислення атомів поза хімічної сполуки дорівнює нулю. Це правило справедливо як для речовин, утворених з окремих вільних атомів, так і для таких, які складаються з двох, або багатоатомних молекул одного елемента.
Визначте, чи є розглядається речовина елементарним. ступінь окислення атомів поза хімічної сполуки дорівнює нулю. Це правило справедливо як для речовин, утворених з окремих вільних атомів, так і для таких, які складаються з двох, або багатоатомних молекул одного елемента.- Наприклад, Al(s) і Cl2 мають ступінь окислення 0, оскільки обидва знаходяться в хімічно незв'язаному елементарному стані.
- Зверніть увагу, що аллотропная форма сірки S8, або октасера, незважаючи на своє нетипове будова, також характеризується нульовим ступенем окислення.
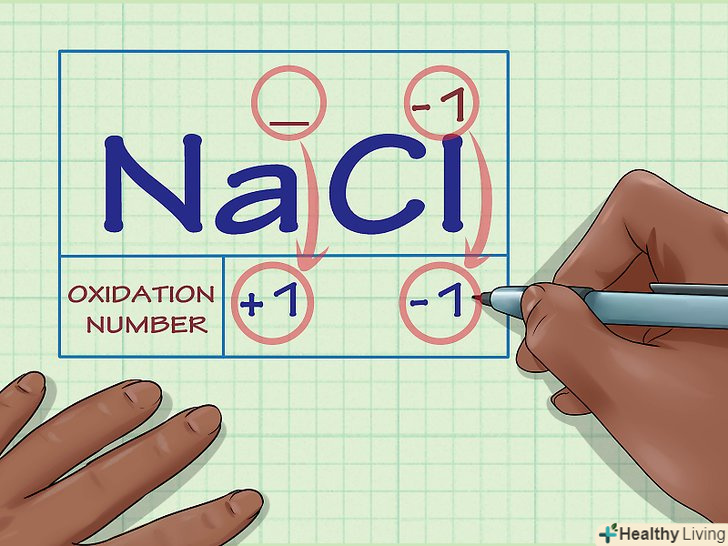
 Визначте, чи складається розглядається речовина з іонів.ступінь окислення іонів дорівнює їх заряду. Це справедливо як для вільних іонів, так і для тих, які входять до складу хімічних сполук.
Визначте, чи складається розглядається речовина з іонів.ступінь окислення іонів дорівнює їх заряду. Це справедливо як для вільних іонів, так і для тих, які входять до складу хімічних сполук.- Наприклад, ступінь окислення іона Cl - дорівнює -1.
- Ступінь окислення іона Cl у складі хімічної сполуки NaCl також дорівнює -1. Оскільки іон Na, за визначенням, має заряд +1, ми робимо висновок, що заряд іона Cl -1, і таким чином ступінь його окислення дорівнює -1.
 Врахуйте, що іони металів можуть мати кілька ступенів окислення.атоми багатьох металевих елементів можуть іонізуватися на різні величини. Наприклад, заряд іонів такого металу як залізо (Fe) дорівнює +2, або +3.[1] Заряд іонів металу (і їх ступінь окислення) можна визначити по зарядах іонів інших елементів, з якими даний метал входить до складу хімічної сполуки; в тексті цей заряд позначається римськими цифрами: так, залізо (III) має ступінь окислення +3.
Врахуйте, що іони металів можуть мати кілька ступенів окислення.атоми багатьох металевих елементів можуть іонізуватися на різні величини. Наприклад, заряд іонів такого металу як залізо (Fe) дорівнює +2, або +3.[1] Заряд іонів металу (і їх ступінь окислення) можна визначити по зарядах іонів інших елементів, з якими даний метал входить до складу хімічної сполуки; в тексті цей заряд позначається римськими цифрами: так, залізо (III) має ступінь окислення +3.- Як приклад розглянемо з'єднання, що містить іон алюмінію. Загальний заряд з'єднання AlCl3 дорівнює нулю. Оскільки нам відомо, що іони Cl - мають заряд -1, і в з'єднанні міститься 3 таких іона, для загальної нейтральності розглянутого речовини іон Al повинен мати заряд +3. Таким чином, в даному випадку ступінь окислення алюмінію дорівнює +3.
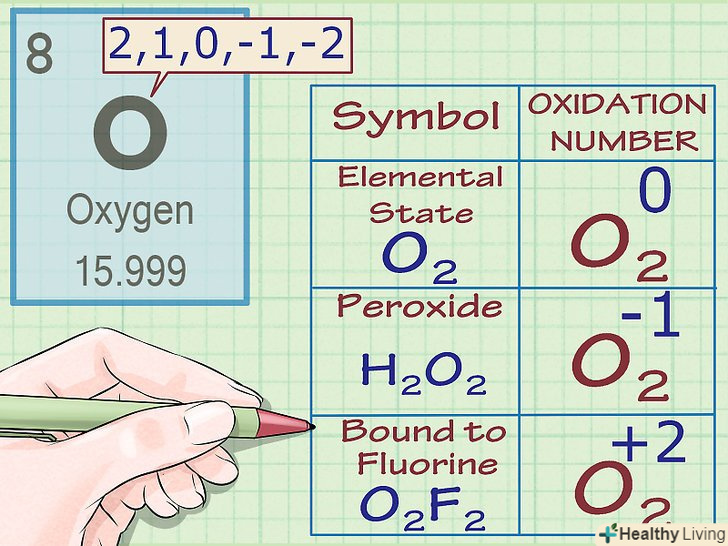
 Ступінь окислення кисню дорівнює -2 (За деякими винятками).майже у всіх випадках атоми кисню мають ступінь окислення -2. Є кілька винятків з цього правила:
Ступінь окислення кисню дорівнює -2 (За деякими винятками).майже у всіх випадках атоми кисню мають ступінь окислення -2. Є кілька винятків з цього правила:- Якщо кисень знаходиться в елементарному стані (O2), його ступінь окислення дорівнює 0, як і в разі інших елементарних речовин.
- Якщо кисень входить до складуперекису, його ступінь окислення дорівнює -1. Перекису-це група сполук, що містять просту кисень-кисневий зв'язок (тобто аніон перекису O2-2). Наприклад, в складі молекули H2O2 (перекис водню) кисень має заряд і ступінь окислення -1.
- У з'єднанні з фтором кисень має ступінь окислення +2, читайте правило для фтору нижче.
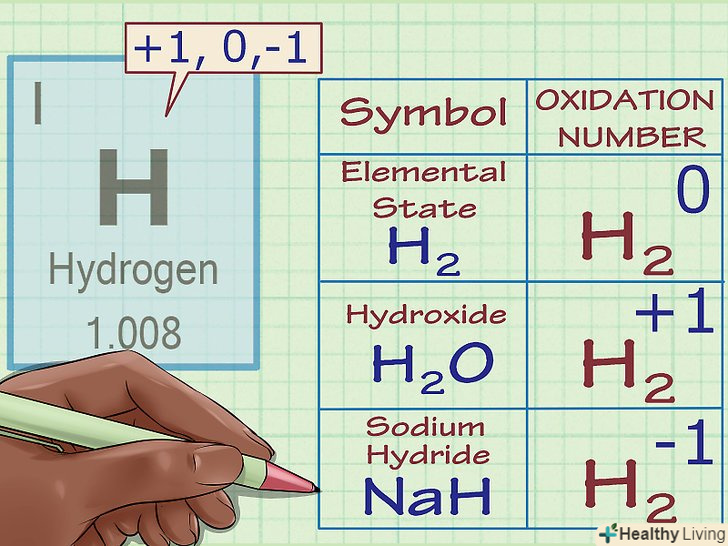
 Водень характеризується ступенем окислення +1, за деякими винятками.як і для кисню, тут також існують винятки. Як правило, ступінь окислення водню дорівнює + 1 (якщо він не знаходиться в елементарному стані h2). Однак в з'єднаннях, званих гідридами, ступінь окислення водню становить -1.
Водень характеризується ступенем окислення +1, за деякими винятками.як і для кисню, тут також існують винятки. Як правило, ступінь окислення водню дорівнює + 1 (якщо він не знаходиться в елементарному стані h2). Однак в з'єднаннях, званих гідридами, ступінь окислення водню становить -1.- Наприклад, в h2o ступінь окислення водню дорівнює +1, оскільки атом кисню має заряд -2, і для загальної нейтральності необхідні два заряди +1. Проте, в складі гідриду натрію ступінь окислення водню вже -1, так як іон na несе заряд +1, і для загальної електронейтральності заряд атома водню (а тим самим і його ступінь окислення) повинен дорівнювати -1.
 Фторзавжди має ступінь окислення -1.як вже було відзначено, ступінь окислення деяких елементів (іони металів, атоми кисню в перекисах і так далі) може змінюватися в залежності від ряду факторів. Ступінь окислення фтору, однак, незмінно становить -1. Це пояснюється тим, що даний елемент має найбільшу електронегативність — інакше кажучи, атоми фтору найменш охоче розлучаються з власними електронами і найбільш активно притягують чужі електрони. Таким чином, їх заряд залишається незмінним.
Фторзавжди має ступінь окислення -1.як вже було відзначено, ступінь окислення деяких елементів (іони металів, атоми кисню в перекисах і так далі) може змінюватися в залежності від ряду факторів. Ступінь окислення фтору, однак, незмінно становить -1. Це пояснюється тим, що даний елемент має найбільшу електронегативність — інакше кажучи, атоми фтору найменш охоче розлучаються з власними електронами і найбільш активно притягують чужі електрони. Таким чином, їх заряд залишається незмінним. Сума ступенів окислення в з'єднанні дорівнює його заряду.ступені окислення всіх атомів, що входять в хімічну сполуку, в сумі повинні давати заряд цього з'єднання. Наприклад, якщо з'єднання нейтрально, сума ступенів окислення всіх його атомів повинна дорівнювати нулю; якщо з'єднання є багатоатомним іоном з зарядом -1, сума ступенів окислення дорівнює -1, і так далі.
Сума ступенів окислення в з'єднанні дорівнює його заряду.ступені окислення всіх атомів, що входять в хімічну сполуку, в сумі повинні давати заряд цього з'єднання. Наприклад, якщо з'єднання нейтрально, сума ступенів окислення всіх його атомів повинна дорівнювати нулю; якщо з'єднання є багатоатомним іоном з зарядом -1, сума ступенів окислення дорівнює -1, і так далі.- Це хороший метод перевірки - якщо сума ступенів окислення не дорівнює загальному заряду з'єднання, значить ви десь помилилися.
Частина2 З 2:
Визначення ступеня окислення без використання законів хімії
Частина2 З 2:
 Знайдіть атоми, які не мають строгих правил щодо ступеня окислення.по відношенню до деяких елементів немає твердо встановлених правил знаходження ступеня окислення. Якщо атом не підпадає ні під одне правило з перерахованих вище, і ви не знаєте його заряду (наприклад, атом входить до складу комплексу, і його заряд не вказано), ви можете встановити ступінь окислення такого атома методом виключення. Спочатку визначте заряд всіх інших атомів з'єднання, а потім з відомого загального заряду з'єднання обчисліть ступінь окислення даного атома.
Знайдіть атоми, які не мають строгих правил щодо ступеня окислення.по відношенню до деяких елементів немає твердо встановлених правил знаходження ступеня окислення. Якщо атом не підпадає ні під одне правило з перерахованих вище, і ви не знаєте його заряду (наприклад, атом входить до складу комплексу, і його заряд не вказано), ви можете встановити ступінь окислення такого атома методом виключення. Спочатку визначте заряд всіх інших атомів з'єднання, а потім з відомого загального заряду з'єднання обчисліть ступінь окислення даного атома.- Наприклад, в з'єднанні na2SO4 невідомий заряд атома сірки (S) — ми лише знаємо, що він не нульовий, оскільки сірка знаходиться не в елементарному стані. Це з'єднання служить хорошим прикладом для ілюстрації алгебраїчного методу визначення ступеня окислення.
 Знайдіть ступеня окислення інших елементів, що входять в з'єднання. за допомогою описаних вище правил визначте ступеня окислення інших атомів з'єднання. Не забувайте про винятки з правил у випадку атомів O, H і так далі.
Знайдіть ступеня окислення інших елементів, що входять в з'єднання. за допомогою описаних вище правил визначте ступеня окислення інших атомів з'єднання. Не забувайте про винятки з правил у випадку атомів O, H і так далі.- Для Na2SO4, користуючись нашими правилами, ми знаходимо, що заряд (а значить і ступінь окислення) іона Na дорівнює +1, а для кожного з атомів кисню він становить -2.
 Помножте кількість атомів на їх ступінь окислення.тепер, коли нам відомі ступені окислення всіх атомів за винятком одного, необхідно врахувати, що атомів деяких елементів може бути кілька. Помножте число атомів кожного елемента (воно зазначено в хімічній формулі з'єднання у вигляді підрядкового числа, наступного за символом елемента) на його ступінь окислення.
Помножте кількість атомів на їх ступінь окислення.тепер, коли нам відомі ступені окислення всіх атомів за винятком одного, необхідно врахувати, що атомів деяких елементів може бути кілька. Помножте число атомів кожного елемента (воно зазначено в хімічній формулі з'єднання у вигляді підрядкового числа, наступного за символом елемента) на його ступінь окислення.- В Na2SO4 ми маємо 2 атома Na і 4 атома O. Таким чином, множачи 2x +1, отримуємо ступінь окислення всіх атомів Na (2), а множачи 4x -2 — ступінь окислення атомів O (-8).
 Складіть попередні результати.підсумовуючи результати множення, отримуємо ступінь окислення з'єднання без обліку вкладу шуканого атома.
Складіть попередні результати.підсумовуючи результати множення, отримуємо ступінь окислення з'єднання без обліку вкладу шуканого атома.- У нашому прикладі для na2SO4 ми складаємо 2 і -8 і отримуємо -6.
 Знайдіть невідому ступінь окислення з заряду з'єднання.тепер у вас є всі дані для простого розрахунку шуканої ступеня окислення. Запишіть рівняння, в лівій частині якого буде сума числа, отриманого на попередньому кроці обчислень, і невідомого ступеня окислення, а в правій — загальний заряд з'єднання. Іншими словами, (сума відомих ступенів окислення) + (шукана ступінь окислення) = (заряд з'єднання).
Знайдіть невідому ступінь окислення з заряду з'єднання.тепер у вас є всі дані для простого розрахунку шуканої ступеня окислення. Запишіть рівняння, в лівій частині якого буде сума числа, отриманого на попередньому кроці обчислень, і невідомого ступеня окислення, а в правій — загальний заряд з'єднання. Іншими словами, (сума відомих ступенів окислення) + (шукана ступінь окислення) = (заряд з'єднання).- У нашому випадку na2SO4 рішення виглядає наступним чином:
- (сума відомих ступенів окислення) + (шукана ступінь окислення) = (заряд з'єднання)
- -6 + S = 0
- S = 0 + 6
- S = 6. У Na2so4 сірка має ступінь окислення 6.
- У нашому випадку na2SO4 рішення виглядає наступним чином:
Поради
- В з'єднаннях сума всіх ступенів окислення повинна дорівнювати заряду. Наприклад, якщо сполука являє собою двоатомний іон, сума ступенів окислення атомів повинна дорівнювати загальному іонному заряду.
- Дуже корисно вміти користуватися періодичною таблицею Менделєєва і знати, де в ній розташовуються металеві і неметалеві елементи.
- Ступінь окислення атомів в елементарному вигляді завжди дорівнює нулю. Ступінь окислення одиничного іона дорівнює його заряду. Елементи групи 1a таблиці Менделєєва, такі як водень, літій, натрій, в елементарному вигляді мають ступінь окислення + 1; ступінь окислення металів групи 2a, таких як магній і кальцій, в елементарному вигляді дорівнює +2. Кисень і водень, в залежності від виду хімічного зв'язку, можуть мати 2 різних значення ступеня окислення.
Що вам знадобиться
- Періодична таблиця елементів
- Доступ в інтернет або довідники з хімії
- аркуш паперу, ручка або олівець
- Калькулятор