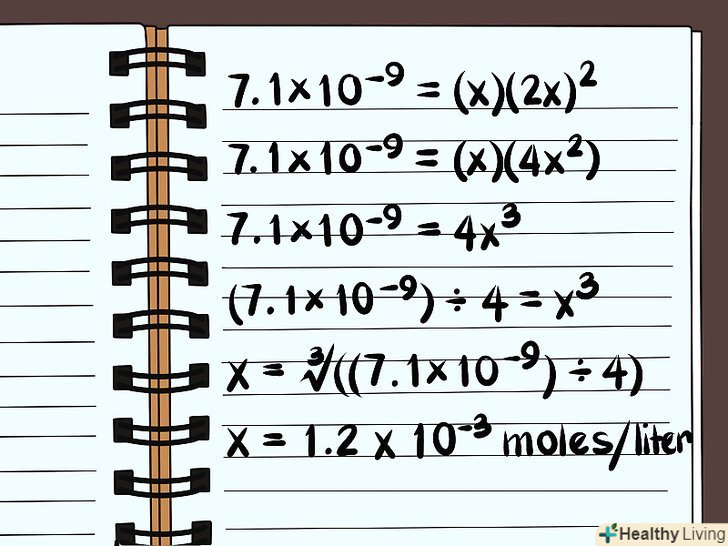Поняття розчинності використовується в хімії для опису властивостей твердої речовини, яка змішується з рідиною і розчиняється в ній. Повністю розчинні лише іонні (заряджені) з'єднання. Для практичних потреб досить пам'ятати кілька правил або вміти знайти їх, щоб при нагоді скористатися ними і дізнатися, розчиняться чи ні ті чи інші іонні речовини у воді. Фактично, в будь-якому випадку розчиняється деяка кількість атомів, навіть якщо зміни не помітні, тому для проведення точних експериментів іноді потрібно обчислити цю кількість.
Кроки
Метод1 З 2:
Використання простих правил
Метод1 З 2:
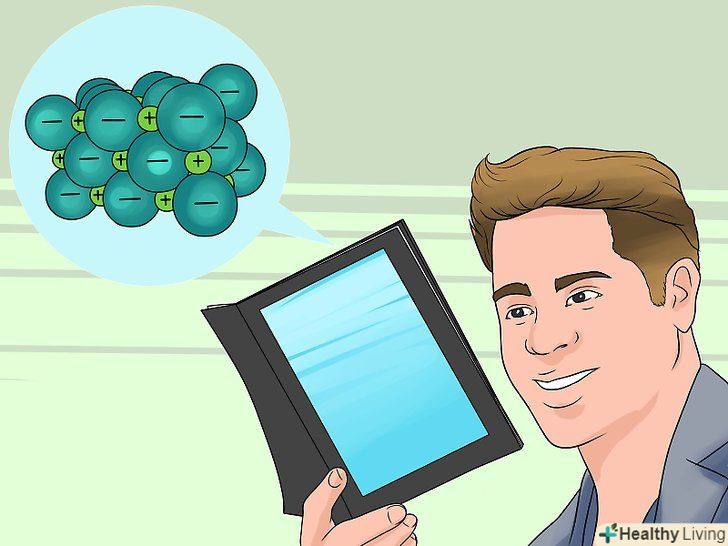
 Дізнайтеся більше про іонні сполуки.у нормальному стані кожен атом має певну кількість електронів, але іноді він може захопити додатковий електрон або втратити свій.[1]
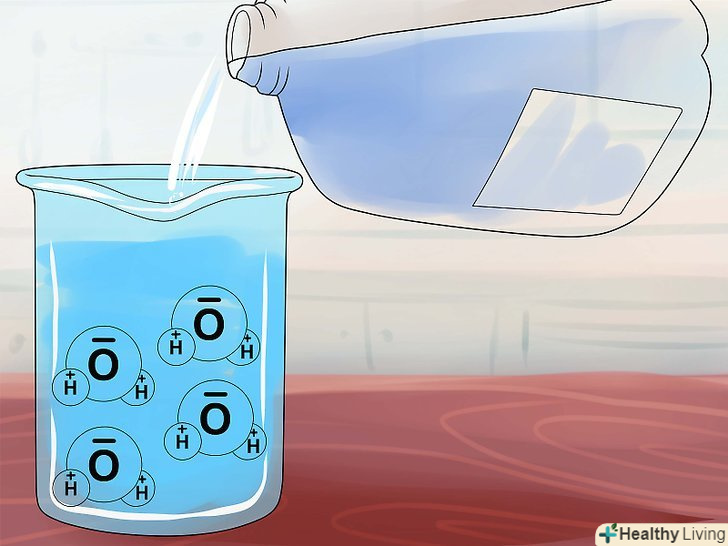
Дізнайтеся більше про іонні сполуки.у нормальному стані кожен атом має певну кількість електронів, але іноді він може захопити додатковий електрон або втратити свій.[1] Дізнайтеся більше про розчинність. молекули води (H2O) мають своєрідну структуру, що робить їх схожими на магніт: з одного кінця вони мають позитивний, а з другого — негативний заряд. При приміщенні в воду іонного з'єднання ці водяні "магніти" збираються навколо його молекул і прагнуть відтягнути позитивні і негативні іони один від одного. Молекули деяких іонних сполук не дуже міцні, і такі речовини розчинні у воді, так як молекули води відтягують іони один від одного і розчиняють їх. В інших сполуках іони зв'язані міцніше, і вони нерозчинні, оскільки молекули води не в змозі розтягнути іони в сторони.[2]
Дізнайтеся більше про розчинність. молекули води (H2O) мають своєрідну структуру, що робить їх схожими на магніт: з одного кінця вони мають позитивний, а з другого — негативний заряд. При приміщенні в воду іонного з'єднання ці водяні "магніти" збираються навколо його молекул і прагнуть відтягнути позитивні і негативні іони один від одного. Молекули деяких іонних сполук не дуже міцні, і такі речовини розчинні у воді, так як молекули води відтягують іони один від одного і розчиняють їх. В інших сполуках іони зв'язані міцніше, і вони нерозчинні, оскільки молекули води не в змозі розтягнути іони в сторони.[2]- У молекулах деяких сполук внутрішні зв'язки можна порівняти за силою з дією молекул води. Такі сполуки називають слабо розчинними, оскільки значна частина їх молекул дисоціює, хоча інші залишаються не розчиненими.
 Вивчіть правила розчинності.оскільки взаємодія між атомами описується досить складними законами, не завжди можна відразу сказати, які речовини розчиняються, а які ні. Знайдіть один з іонів сполуки в наведеному нижче описі того, як зазвичай поводяться різні речовини. Після цього зверніть увагу на другий іон і перевірте, чи не відноситься дана речовина до винятків через незвичайного взаємодії іонів.
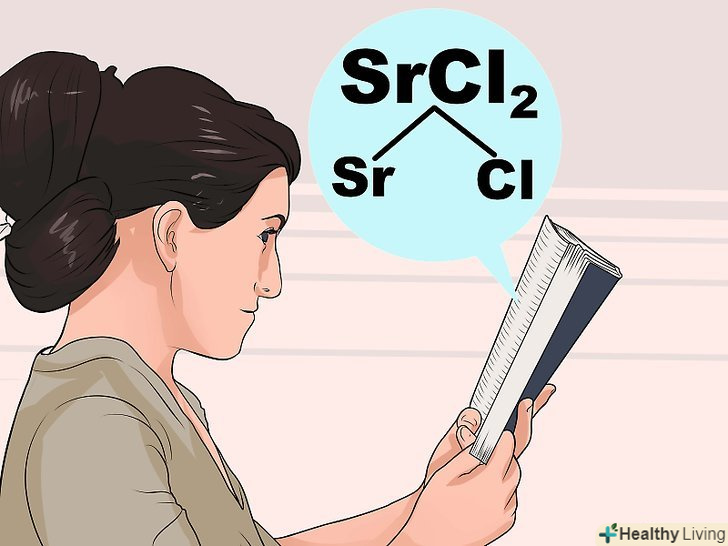
Вивчіть правила розчинності.оскільки взаємодія між атомами описується досить складними законами, не завжди можна відразу сказати, які речовини розчиняються, а які ні. Знайдіть один з іонів сполуки в наведеному нижче описі того, як зазвичай поводяться різні речовини. Після цього зверніть увагу на другий іон і перевірте, чи не відноситься дана речовина до винятків через незвичайного взаємодії іонів.- Припустимо, ви маєте справу з хлоридом стронцію (SrCl2). Знайдіть у наведених нижче кроках (вони виділені жирним шрифтом) іони Sr і Cl. Cl зазвичай розчинний; після цього загляньте в наведені нижче винятки. Іони Sr там не згадані, так що з'єднання SrCl має розчинятися у воді.
- Нижче відповідних правил наведені найбільш поширені винятки. Існують і інші винятки, однак ви навряд чи зіткнетеся з ними на уроках хімії або в лабораторії.
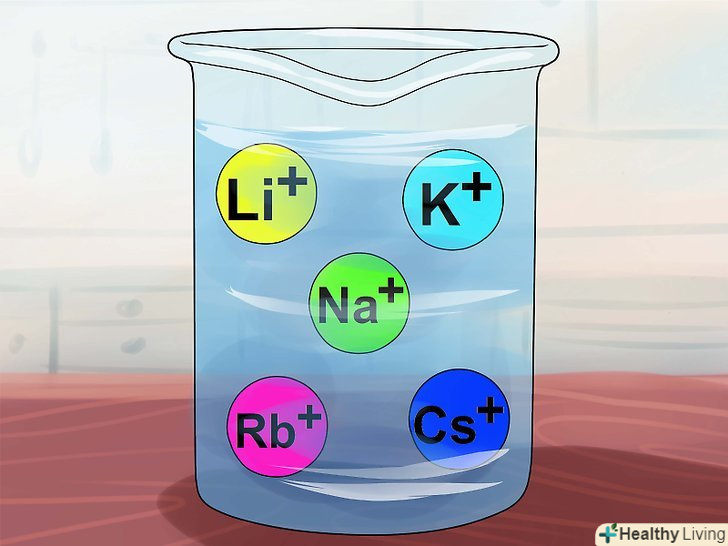
 Сполуки розчинні, якщо до їх складу входять іони лужних металів, тобто Li+, Na+, K+, Rb+ і Cs+ .це елементи групи ia таблиці Менделєєва: літій, натрій, калій, рубідій і цезій. Майже всі прості сполуки цих елементів розчинні.
Сполуки розчинні, якщо до їх складу входять іони лужних металів, тобто Li+, Na+, K+, Rb+ і Cs+ .це елементи групи ia таблиці Менделєєва: літій, натрій, калій, рубідій і цезій. Майже всі прості сполуки цих елементів розчинні.- Виняток: з'єднання Li3PO4 нерозчинне.
 Сполуки іонів NO3-, C2H3O2-, NO2-, ClO3- і ClO4- розчинні.їх називають відповідно іонами нітратів, ацетатів, нітритів, хлоратів і перхлоратів. Іон ацетату часто позначають абревіатурою ОАс.[3]
Сполуки іонів NO3-, C2H3O2-, NO2-, ClO3- і ClO4- розчинні.їх називають відповідно іонами нітратів, ацетатів, нітритів, хлоратів і перхлоратів. Іон ацетату часто позначають абревіатурою ОАс.[3]- Винятки: Ag (OAc) (ацетат срібла) і Hg(OAc)2 (ацетат ртуті) нерозчинні.
- AgNO2- і KClO4- лише слабо розчинні.
 Сполуки іонів Cl - , Br - і I- зазвичай розчинні.іони хлору, брому і йоду утворюють відповідно хлориди, Бориди і йодиди, які називають солями галогенів. Ці солі майже завжди розчинні.
Сполуки іонів Cl - , Br - і I- зазвичай розчинні.іони хлору, брому і йоду утворюють відповідно хлориди, Бориди і йодиди, які називають солями галогенів. Ці солі майже завжди розчинні.- Виняток: якщо другим іоном в парі є іон срібла Ag + , ртуті Hg22+ або свинцю Pb2+, сіль нерозчинна. Це ж вірно і для менш поширених галогенів з іонами міді Cu+ і талію Tl+.
 Сполуки іона SO42- (сульфати) зазвичай розчинні.як правило, сульфати розчиняються у воді, проте існує кілька винятків.
Сполуки іона SO42- (сульфати) зазвичай розчинні.як правило, сульфати розчиняються у воді, проте існує кілька винятків.- Винятки: нерозчинні сульфати наступних іонів: стронцію Sr2+, барію Ba2+, свинцю Pb2+, срібла Ag+, кальцію Ca2+, радію Ra2+ і двовалентного срібла Hg22+. Врахуйте, що сульфат срібла і сульфат кальцію все ж трохи розчиняються у воді, і іноді їх вважають злегка розчинними речовинами.
 Сполуки OH- і S2- нерозчинні у воді. Це відповідно іони гідроксиду і сульфіду.
Сполуки OH- і S2- нерозчинні у воді. Це відповідно іони гідроксиду і сульфіду.- Винятки: пам'ятайте про лужні метали (група IA) і про те, що майже всі їх сполуки розчинні? Так ось, іони Li + , Na + , K + , Rb+і Cs + утворюють розчинні гідроксиди і сульфіди. Крім того, розчинні солі кальцію ca2+, стронцію Sr2+ і барію Ba2+ (група IIA). Врахуйте, що значна частина молекул гідроксидів цих елементів все ж не розчиняється, тому іноді їх вважають слабо розчинними.
 Сполуки іонів CO32- і PO43- нерозчинні.ці іони утворюють карбонати і фосфати, які зазвичай не розчиняються у воді.
Сполуки іонів CO32- і PO43- нерозчинні.ці іони утворюють карбонати і фосфати, які зазвичай не розчиняються у воді.- Винятки: дані іони утворюють розчинні сполуки з іонами лужних металів: Li+, Na+, K+, Rb+ і Cs+, а також з амонієм NH4+ .
Метод2 З 2:
Використання добутку розчинності ksp
Метод2 З 2:
 Знайдіть добуток розчинності ksp (це постійна величина). кожне з'єднання має свою константу Ksp. Її значення для різних речовин наведені в довідниках і на сайті (англійською мовою). Значення добутку розчинності визначаються експериментально і вони можуть значно відрізнятися один від одного в різних джерелах, тому краще користуватися таблицею для ksp у вашому підручнику хімії, якщо така таблиця там є. Якщо не вказано іншого, в більшості таблиць наводиться добуток розчинності при температурі 25ºC.
Знайдіть добуток розчинності ksp (це постійна величина). кожне з'єднання має свою константу Ksp. Її значення для різних речовин наведені в довідниках і на сайті (англійською мовою). Значення добутку розчинності визначаються експериментально і вони можуть значно відрізнятися один від одного в різних джерелах, тому краще користуватися таблицею для ksp у вашому підручнику хімії, якщо така таблиця там є. Якщо не вказано іншого, в більшості таблиць наводиться добуток розчинності при температурі 25ºC.- Наприклад, якщо ви розчиняєте йодид свинцю PbI2, знайдіть для нього добуток розчинності. На сайті bilbo.chm.uri.edu вказано значення 7,1 x 10-9.
 Запишіть хімічне рівняння.спочатку визначте, на які іони розпадеться молекула речовини при розчиненні. Потім запишіть рівняння з ksp з одного боку і відповідними іонами з іншого.
Запишіть хімічне рівняння.спочатку визначте, на які іони розпадеться молекула речовини при розчиненні. Потім запишіть рівняння з ksp з одного боку і відповідними іонами з іншого.- У нашому прикладі молекула PbI2 розщеплюється на іон Pb2+ і два іони i-. При цьому досить встановити заряд лише одного іона, так як в цілому розчин буде нейтральним.
- Запишіть рівняння: 7,1 х 10-9 = [Pb2 + ][i-]2.
 Перетворіть рівняння так, щоб вирішити його.перепишіть рівняння в простому алгебраїчному вигляді. Використовуйте при цьому те, що вам відомо про кількість молекул і іонів. Підставте замість числа атомів розчиняється з'єднання невідому величину х і висловіть кількість іонів через х.
Перетворіть рівняння так, щоб вирішити його.перепишіть рівняння в простому алгебраїчному вигляді. Використовуйте при цьому те, що вам відомо про кількість молекул і іонів. Підставте замість числа атомів розчиняється з'єднання невідому величину х і висловіть кількість іонів через х.- У нашому прикладі необхідно переписати наступне рівняння: 7,1 x 10-9 = [Pb2+][I-]2.
- Оскільки в з'єднання входить лише один атом свинцю (Pb), число розчинених молекул буде дорівнювати кількості вільних іонів свинцю. Таким чином, ми можемо прирівняти [Pb2 + ] і x.
- Оскільки на кожен іон свинцю припадає два іони йоду (I), число атомів йоду слід прирівняти 2x.
- В результаті виходить рівняння 7,1 х 10-9 = (x)(2x)2.
 При необхідності врахуйте загальні іони.пропустіть цей крок, якщо речовина розчиняється в чистій воді. Однак якщо ви використовуєте розчин, який вже містить один або більше цікавлять вас іонів (загальних іонів), розчинність може значно знизитися.[4] ефект загальних іонів особливо помітний для слабо розчинних речовин, і в подібних випадках можна припускати, що переважна більшість розчинених іонів вже були присутні в розчині раніше. Перепишіть рівняння і врахуйте в ньому відомі молярні концентрації (молей на літр, або M) вже розчинених іонів. Відкоригуйте невідомі величини х для цих іонів.[5]
При необхідності врахуйте загальні іони.пропустіть цей крок, якщо речовина розчиняється в чистій воді. Однак якщо ви використовуєте розчин, який вже містить один або більше цікавлять вас іонів (загальних іонів), розчинність може значно знизитися.[4] ефект загальних іонів особливо помітний для слабо розчинних речовин, і в подібних випадках можна припускати, що переважна більшість розчинених іонів вже були присутні в розчині раніше. Перепишіть рівняння і врахуйте в ньому відомі молярні концентрації (молей на літр, або M) вже розчинених іонів. Відкоригуйте невідомі величини х для цих іонів.[5]- Наприклад, якщо йодид свинцю вже присутній в розчині з концентрацією 0,2 M, слід переписати рівняння наступним чином: 7,1 x 10-9 = (0,2 M+x)(2x)2. Оскільки величина 0,2 M набагато більше x, можна записати рівняння у вигляді 7,1 x 10-9 = (0,2 M) (2x)2.
 Вирішіть рівняння. знайдіть величину x, щоб дізнатися, наскільки розчинна дана сполука. З огляду на визначення добутку розчинності відповідь буде виражений в молях розчиненої речовини на літр води. Для обчислення кінцевого результату може знадобитися калькулятор.
Вирішіть рівняння. знайдіть величину x, щоб дізнатися, наскільки розчинна дана сполука. З огляду на визначення добутку розчинності відповідь буде виражений в молях розчиненої речовини на літр води. Для обчислення кінцевого результату може знадобитися калькулятор.- Для розчинення в чистій воді, тобто при відсутності загальних іонів, знаходимо:
- 7,1×10–9 = (x)(2x)2
- 7,1×10–9 = (x)(4x2)
- 7,1×10–9 = 4x3
- (7,1×10–9)/4 = x3
- X = ∛((7,1×10–9)/4)
- X =1,2 x 10-3 молей на літр води. Це дуже мала кількість, тому дана речовина практично нерозчинно.
Що вам знадобиться
- таблиця добутків розчинності (Ksp ) різних сполук.
Поради
- Якщо є експериментальні дані про розчинність сполуки, можна використовувати те саме рівняння для того, щоб обчислити добуток розчинності ksp для даної речовини.[6]
Попередження
- Незважаючи на відсутність загальноприйнятої згоди щодо термінів, хіміки згодні щодо більшості речовин. Розбіжності можуть виникнути лише в разі небагатьох з'єднань, для яких в різних таблицях наведені різні значення.
- У деяких досить старих довідниках з'єднання NH4OH віднесено до розчинних. Це невірно: хоча і можна виявити іони NH4 + і OH- в малих кількостях, їх не можна виділити, щоб отримати з'єднання.[7]
Джерела
- ↑ Http://www.nyu.edu/classes/tuckerman/adv.chem/lectures/lecture_10/node6.html
- ↑ Http://chemed.chem.purdue.edu/genchem/topicreview/bp/ch18/soluble.php
- ↑ Http://www.chem.sc.edu/faculty/morgan/resources/solubility/
- ↑ Http://catalog.flatworldknowledge.com/bookhub/4309?e=averill_1.0-ch17_s01#
- ↑ Http://chemwiki.ucdavis.edu/Physical_Chemistry/Equilibria/Solubilty/Common_Ion_Effect
- ↑ Https://www.youtube.com/watch?v=ywOStvnBYTo
- ↑ Http://www.chemteam.info/Equations/Solubility-Table.html