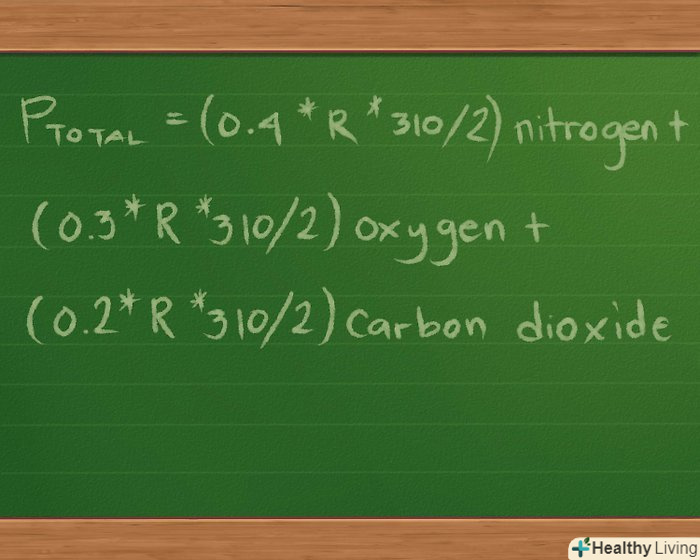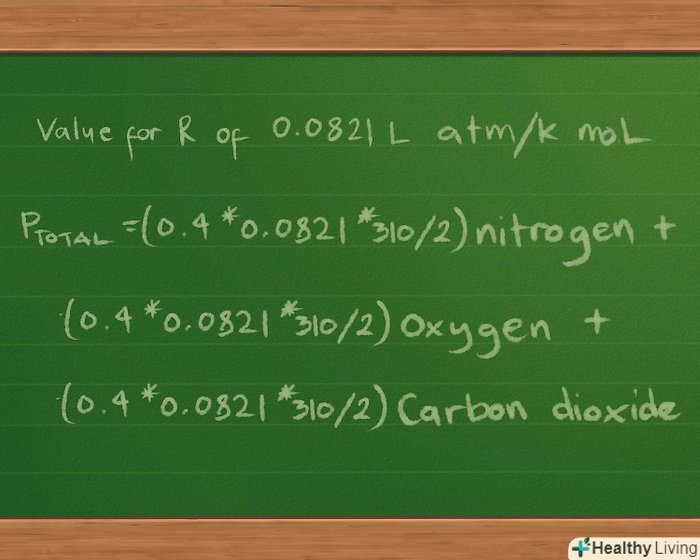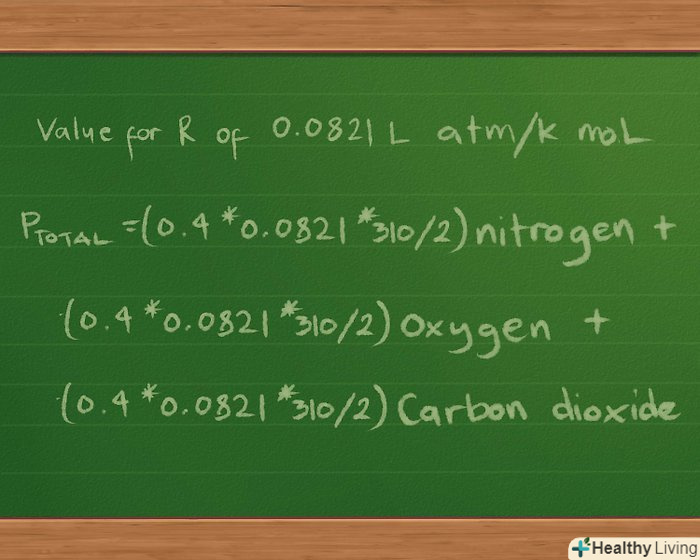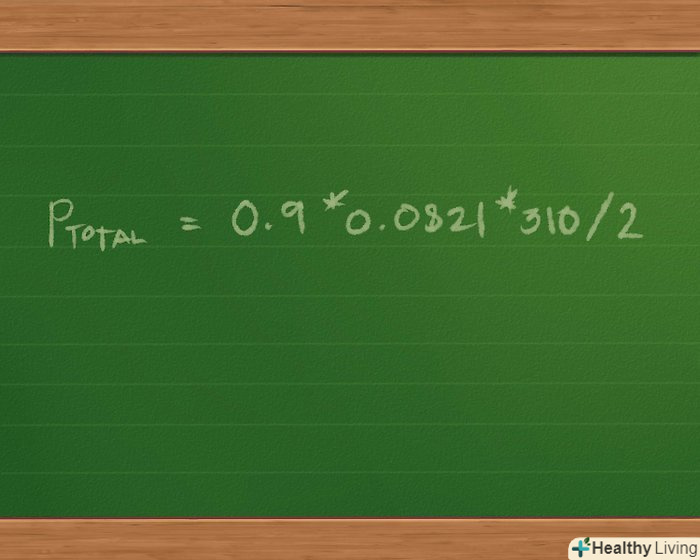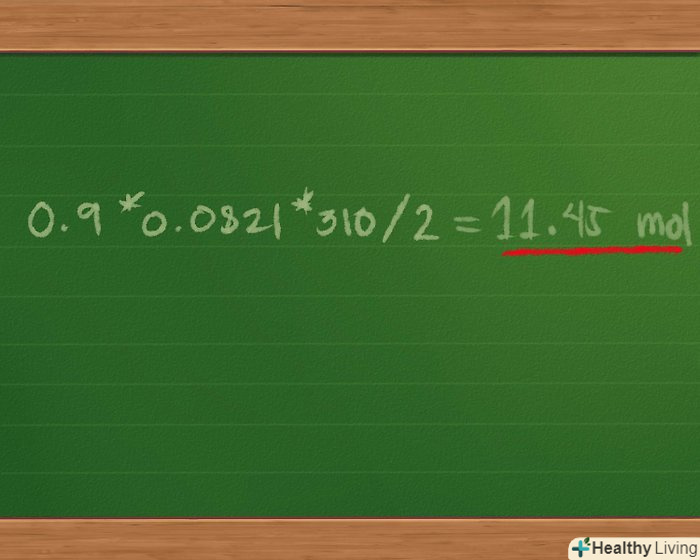В хімії "парціальним тиском" називають тиск, який надає окремо взятий компонент з газової суміші зовнішнього середовища, наприклад, на колбу, балон або кордон атмосфери. Ви можете підрахувати тиск кожного газу, якщо знаєте його кількість, який обсяг він займає і яка його температура. Потім ви можете скласти парціальні тиску і знайти загальний парціальний тиск суміші газів, або знайдіть спочатку загальний тиск, а потім — парціальний.
Кроки
Частина1З 3:
Розуміння властивості газів
Частина1З 3:
 Прийміть кожен газ як "ідеальний".у хімії "ідеальний газ" - той, який взаємодіє з іншими речовинами, не вступаючи з ними в з'єднання. Окремі молекули можуть стикатися один з одним і відштовхуватися, як кулі для більярду, не деформуючись при цьому.[1]
Прийміть кожен газ як "ідеальний".у хімії "ідеальний газ" - той, який взаємодіє з іншими речовинами, не вступаючи з ними в з'єднання. Окремі молекули можуть стикатися один з одним і відштовхуватися, як кулі для більярду, не деформуючись при цьому.[1]- Тиск ідеального газу зростає, якщо його помістити в менший обсяг, і зменшується, якщо газ знаходиться в більшому обсязі. Це ставлення називається законом Бойля-Маріотта, на ім'я вчених Роберта Бойля і Едма Маріотта. Математичний запис Закону: k = P x V або, спрощено, k = PV, де k представляє константу співвідношення, P-тиск, а V — обсяг.[2]
- Тиск може бути вказано в декількох різних одиницях. Одна з них, Паскаль (Па), визначається як сила в 1 ньютон, прикладена до площі в 1 квадратний метр. Інший варіант подання тиску - в атмосферах (атм). Ця одиниця визначається як тиск земної атмосфери на рівні моря. Тиск в 1 атмосферу дорівнює 101,325 Па.[3]
- Температура ідеального газу зростає при збільшенні його обсягу і знижується при зменшенні обсягу. Це ставлення називають законом Чарльза, на ім'я Жака Чарльза. Математичний запис Закону: k = V / T, де k — константа співвідношення між об'ємом і температурою, V знову представляє обсяг газу, а T — його температуру.[4][5]
- Температура газів в цих рівняннях приведена в градусах Кельвіна, її можна знайти, додавши 273 до числа градусів Цельсія в температурі газу.
- Ці два відносини можна об'єднати в одне рівняння: k = PV / T, яке також можна записати як PV = kT.
 Визначте кількість газів.у газів є і маса, і обсяг. Обсяг зазвичай вимірюють в літрах (л), але є два варіанти підрахунку маси.
Визначте кількість газів.у газів є і маса, і обсяг. Обсяг зазвичай вимірюють в літрах (л), але є два варіанти підрахунку маси.- Зазвичай масу вимірюють в грамах або, якщо вона досить велика, в кілограмах.
- Оскільки гази зазвичай важать дуже мало, їх маса також обчислюється в окремій одиниці виміру, званої молекулярною масою, або молярною масою. Молярна маса визначається як сума атомарних ваг всіх атомів у газоподібній речовині, кожен атом порівнюється з масою карбону (12)[6]
- Оскільки атоми і молекули занадто малі, щоб працювати з ними безпосередньо, кількість газу визначається в молях. Кількість молей в даному газі можна знайти, розділивши масу на молярну масу, значення відзначається буквою n.
- Ми можемо замінити постійну k константу в рівнянні газу числом n, кількістю молей (mol), і ввести нову константу R. тоді рівняння буде записано у вигляді nR = PV/T або PV = nRT.[7]
- Значення R залежить від одиниць, в яких вимірюються тиск газу, обсяги і температура. Для обсягу в літрах, температури в Кельвінах і тиску в атмосферах, значення дорівнює 0,0821 л атм/k мовляв. Це можна записати у вигляді 0,0821 л атм k-1 мовляв -1, щоб уникнути використання розділової риси при вказівці одиниць виміру.[8]
 Розуміння закону Дальтона про парціальний тиск.Закон, відкритий хіміком і фізиком Джоном Дальтоном, який першим припустив, що хімічні елементи складаються з окремих атомів,[9] говорить: загальний тиск суміші газів дорівнює сумі тисків кожного газу в суміші.
Розуміння закону Дальтона про парціальний тиск.Закон, відкритий хіміком і фізиком Джоном Дальтоном, який першим припустив, що хімічні елементи складаються з окремих атомів,[9] говорить: загальний тиск суміші газів дорівнює сумі тисків кожного газу в суміші.- Закон Дальтона можна записати в такому вигляді: Pзагальне = P1 + P2 + P3 ... з такою кількістю доданків після знака рівності, яка кількість газів в суміші.
- Рівняння Закону Дальтона можна розширити при роботі з газами, чий індивідуальний тиск невідомо, але для яких відомі температура і обсяг. Парціальний тиск газу-таке ж, як і для рівного обсягу газу, повністю займає відведений обсяг.
- Для кожного парціального тиску ми можемо переписати рівняння ідеального газу. Замість PV = nRT ми може залишити тільки P в лівій частині перед знаком рівності. Щоб зробити це, обидві частини рівняння потрібно розділити на V: PV / V = nRT / V. дві V зліва скорочуються, залишається P = nRT / V.
- Потім для кожного p праворуч ми можемо виконати заміну, вписавши рівняння парціального тиску: Pзагальне =(nRT/V) 1 +(nRT / V) 2 +(nRT / V) 3 ...
Частина2З 3:
Підрахунок парціального, потім загального тиску
Частина2З 3:
 Визначте рівняння парціального тиску для газів, з якими ви працюєте. для обчислювальних цілей візьмемо приклад: в колбі об'ємом 2 літри міститься 2 газу, Нітроген (N2), оксиген (O2) і карбон діоксид, вуглекислий газ (CO2). Кожного газу - по 10 г, температура кожного газу в колбі дорівнює 37 градусам Цельсія. Потрібно знайти парціальний тиск кожного газу і загальний тиск суміші газів на ємність.
Визначте рівняння парціального тиску для газів, з якими ви працюєте. для обчислювальних цілей візьмемо приклад: в колбі об'ємом 2 літри міститься 2 газу, Нітроген (N2), оксиген (O2) і карбон діоксид, вуглекислий газ (CO2). Кожного газу - по 10 г, температура кожного газу в колбі дорівнює 37 градусам Цельсія. Потрібно знайти парціальний тиск кожного газу і загальний тиск суміші газів на ємність.- Наше рівняння парціального тиску буде виглядати наступним чином: Ptotal = PНітроген + Pоксиген + Pкарбон діоксид.
- Оскільки ми намагаємося знайти тиск, який чинить кожен з газів, знаємо обсяг і температуру і можемо знайти кількість молей кожного газу, грунтуючись на масі речовини, ми можемо переписати рівняння в наступній формі: Pзагальне =(nRT / V) Нітроген +(nRT / V) оксиген +(nRT / V) карбон діоксид
 Переведіть температуру в градуси Кельвіна.температура за Цельсієм дорівнює 37 градусам, тому ми додамо 273 до 37 і отримаємо 310 градусів K.
Переведіть температуру в градуси Кельвіна.температура за Цельсієм дорівнює 37 градусам, тому ми додамо 273 до 37 і отримаємо 310 градусів K. Знайдіть кількість молей кожного газу в зразку. число молей газу дорівнює масі газу, поділеній на його молярну масу, [10] яка, як уже говорилося, дорівнює сумі ваг всіх атомів в складі.
Знайдіть кількість молей кожного газу в зразку. число молей газу дорівнює масі газу, поділеній на його молярну масу, [10] яка, як уже говорилося, дорівнює сумі ваг всіх атомів в складі.- Для нашого першого газу, нітрогену (N2), кожен атом має атомарну масу 14. Оскільки Нітроген містить два атоми (складається з двохатомних молекул), ми повинні помножити 14 на 2, щоб знайти молярну масу нітрогену, вона дорівнює 28. Потім ми ділимо масу в грамах, 10 г, на 28, щоб отримати кількість молей, яке приблизно дорівнює 0,4 моль.
- У другого газу, Оксигену (O2), маса кожного атома дорівнює 16. Оксиген також двоатомний газ, тому ми множимо 16 на 2 і отримуємо молярну масу, рівну 32. Розділивши 10 г на 32, ми отримаємо приблизно 0,3 моль Оксигену в складі зразка суміші газів.
- Третій газ, карбон діоксид (CO2), складається з 3 атомів: одного атома Карбону з атомарною масою 12 і двох атомів Оксигену, кожен з атомарною масою 16. Ми складаємо всі три ваги: 12 + 16 + 16 = 44 становить молярну масу. Розділивши 10 г на 44, ми отримаємо приблизно 0,2 моля карбон діоксиду.
 Підставте значення для молей, обсягу і температури. Наше рівняння буде виглядати так: pзагальне =(0,4 * R *310/2) Нітроген + (0,3 * R * 310/2) оксиген + (0,2 *R * 310/2) карбон діоксид.
Підставте значення для молей, обсягу і температури. Наше рівняння буде виглядати так: pзагальне =(0,4 * R *310/2) Нітроген + (0,3 * R * 310/2) оксиген + (0,2 *R * 310/2) карбон діоксид.- Для простоти ми залишили поточні значення одиниць виміру. Ці одиниці підуть після математичних обчислень, і залишаться тільки ті, які беруть участь у визначенні тиску.
 Підставте значення константи R. ми будемо вказувати парціальний і загальний тиск в атмосферах, тому використовуємо значення R, Рівне 0,0821 л атм/k моль. Підстановка цього значення в рівняння дає нам p загальне =(0,4 * 0,0821 * 310/2) Нітроген + (0,3 *0,0821 * 310/2) оксиген + (0,2 * 0,0821 * 310/2) карбон діоксид.
Підставте значення константи R. ми будемо вказувати парціальний і загальний тиск в атмосферах, тому використовуємо значення R, Рівне 0,0821 л атм/k моль. Підстановка цього значення в рівняння дає нам p загальне =(0,4 * 0,0821 * 310/2) Нітроген + (0,3 *0,0821 * 310/2) оксиген + (0,2 * 0,0821 * 310/2) карбон діоксид. Підрахуйте парціальний тиск кожного газу.зараз всі значення на місці, пора перейти до математичних обчислень.
Підрахуйте парціальний тиск кожного газу.зараз всі значення на місці, пора перейти до математичних обчислень.- Щоб знайти парціальний тиск нітрогену, помножимо 0,4 моль на нашу константу 0,0821 і температуру 310 градусів K, потім розділимо на 2 літри: 0,4 * 0,0821 * 310/2 = 5,09 атм, приблизно.
- Для отримання парціального тиску Оксигену помножимо 0,3 моль на константу 0,0821 і температуру 310 градусів K, потім розділимо на 2 літри: 0,3 *0,0821 * 310/2 = 3,82 атм, приблизно.
- Щоб знайти парціальний тиск карбон діоксиду, множимо 0,2 моль на константу 0,0821 і температуру 310 градусів K, потім ділимо на 2 літри: 0,2 * 0,0821 * 310/2 = 2,54 атм, приблизно.
- Тепер складемо отримані значення тисків і знайдемо загальний тиск: Pзагальне = 5,09 + 3,82 + 2,54, або 11,45 атм, приблизно.
Частина3З 3:
Обчислення загального, потім парціального тиску
Частина3З 3:
 Визначте парціальний тиск, як і раніше. знову, візьмемо в приклад колбу на 2 літри з трьома газами: нітрогеном (N2), оксигеном (O2) і карбон діоксидом (CO2). У нас по 10 г кожного газу, температура кожного газу в колбі дорівнює 37 °C.
Визначте парціальний тиск, як і раніше. знову, візьмемо в приклад колбу на 2 літри з трьома газами: нітрогеном (N2), оксигеном (O2) і карбон діоксидом (CO2). У нас по 10 г кожного газу, температура кожного газу в колбі дорівнює 37 °C.- Температура по Кельвіну буде такою ж, 310 градусів, як і раніше, у нас буде приблизно 0,4 моль нітрогену, 0,3 моль Оксигену і 0,2 моль карбон діоксиду.
- Ми також будемо вказувати тиск в атмосферах, тому будемо використовувати значення 0,0821 л атм / k моль для константи R.
- Таким чином, наше рівняння парціального тиску на поточний момент виглядає так само, як раніше: pзагальне =(0,4 * 0,0821 * 310/2) Нітроген + (0,3 *0,0821 * 310/2) оксиген + (0,2 * 0,0821 * 310/2) карбон діоксид.
 Складіть кількість молей кожного газу в зразку, щоб знайти загальну кількість молей в суміші газів. оскільки обсяг і температура однакові для всіх газів, не кажучи про те, що кожна молярна маса множиться на одну і ту ж константу, ми можемо використовувати розподільну властивість множення і переписати рівняння в наступному вигляді: p загальне = (0,4 + 0,3 + 0,2) * 0,0821 * 310/2.
Складіть кількість молей кожного газу в зразку, щоб знайти загальну кількість молей в суміші газів. оскільки обсяг і температура однакові для всіх газів, не кажучи про те, що кожна молярна маса множиться на одну і ту ж константу, ми можемо використовувати розподільну властивість множення і переписати рівняння в наступному вигляді: p загальне = (0,4 + 0,3 + 0,2) * 0,0821 * 310/2.- Складаємо 0,4 + 0,3 + 0,2 = 0,9 моль суміші газів. Це спростить наш вираз до Pзагальне = 0,9 * 0,0821 * 310/2.
 Знайдіть загальний тиск суміші газів.множимо 0,9 * 0,0821 * 310/2 = 11,45 моль, приблизно.
Знайдіть загальний тиск суміші газів.множимо 0,9 * 0,0821 * 310/2 = 11,45 моль, приблизно. Знайдіть пропорцію кожного газу в суміші.для цього розділіть кількість молей кожного газу на загальну кількість молей в суміші.
Знайдіть пропорцію кожного газу в суміші.для цього розділіть кількість молей кожного газу на загальну кількість молей в суміші.- У нас 0,4 моль нітрогену, тому 0,4 / 0,9 = 0,44 (44 відсотка) в зразку, приблизно.
- У нас 0,3 моль Оксигену, тому 0,3 / 0,9 = 0,33 (33 відсотка) в зразку, приблизно.
- У нас 0,2 моль карбон діоксиду, тому 0,2 / 0,9 = 0,22 (22 відсотка) в зразку, приблизно.
- Хоча в обчисленнях вище сума приблизних значень у відсотках дає всього 0,99, точні значення є періодичними, так що сума насправді буде дорівнює повторюваним дев'яткам після коми. За визначенням це те ж саме, що 1 або 100 відсотків.
 Помножимо пропорційну кількість кожного газу на загальний тиск, щоб знайти парціальний тиск.
Помножимо пропорційну кількість кожного газу на загальний тиск, щоб знайти парціальний тиск.- Множимо 0,44 * 11,45 = 5,04 атм, приблизно.
- Множимо 0,33 * 11,45 = 3,78 атм, приблизно.
- Множимо 0,22 * 11,45 = 2,52 атм, приблизно.
Поради
- Ви помітите невелику різницю в значеннях при обчисленні спочатку парціального тиску, а потім загального, і при підрахунку спочатку загального, а потім парціального тиску. Пам'ятайте, що наведені значення дані приблизно, оскільки вони округлені до 1 або 2 знаків після коми для простоти підрахунків і розуміння. Якщо ви виконуєте обчислення самостійно без округлення, ви помітите або меншу різницю між значеннями або не помітите її зовсім.
Попередження
Вам будуть потрібні
- Калькулятор
- Довідник атомарних ваг / молярних мас
Джерела
- ↑ Http://hyperphysics.phy-astr.gsu.edu/hbase/kinetic/idegas.html
- ↑ Http://www.grc.nasa.gov/WWW/k-12/airplane/boyle.html
- ↑ Http://en.wikipedia.org/wiki/Atmosphere_(unit)
- ↑ Http://www.chm.davidson.edu/vce/gaslaws/charleslaw.html
- ↑ Http://www.ausetute.com.au/charslaw.html
- ↑ Http://www.ausetute.com.au/mmcalcul.html
- ↑ Http://www.ausetute.com.au/partialp.html
- ↑ Http://www.ausetute.com.au/idealgas.html
- ↑ Http://www.mikeblaber.org/oldwine/chm1045/notes/Gases/Mixtures/Gases06.htm