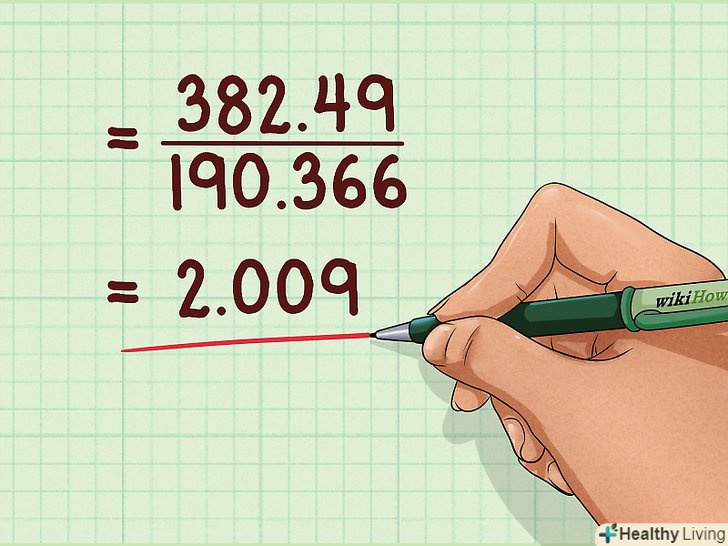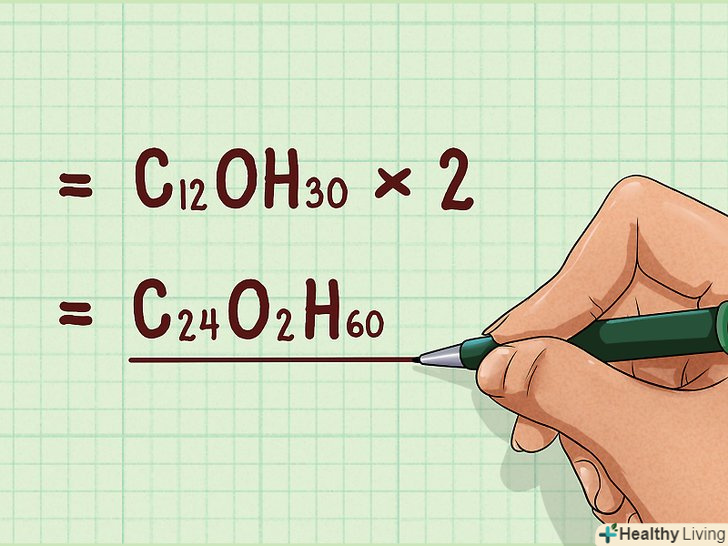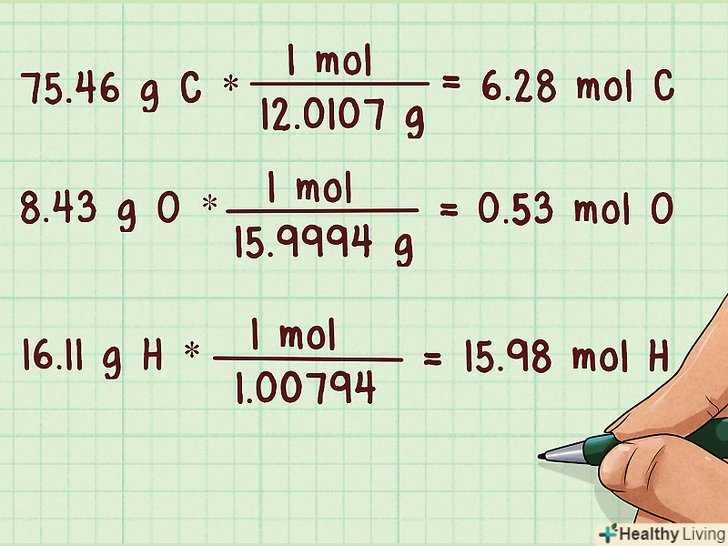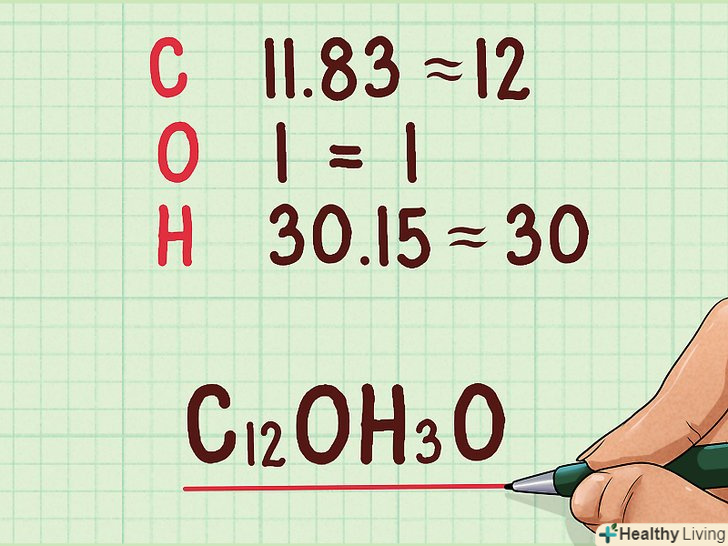Молекулярна формула містить важливу інформацію про відповідну хімічну сполуку. По ній можна визначити, з яких атомів складається дане з'єднання, і скільки атомів кожного елемента міститься в ньому. Для знаходження молекулярної формули необхідно знати емпіричну формулу. Щоб отримати з емпіричної формули молекулярну, слід помножити експериментальні значення на цілочисельний множник.
Кроки
Частина1З 3:
Висновок молекулярної формули з емпіричної формули
Частина1З 3:
 Необхідно розуміти зв'язок між молекулярною і емпіричною формулами.емпірична формула показує кількісне співвідношення атомів у молекулі: наприклад, два атоми кисню на кожен атом вуглецю. Молекулярна формула вказує на те, скільки атомів кожного виду входить до складу молекули: наприклад, один атом вуглецю і два атоми кисню (діоксид вуглецю, або вуглекислий газ). Ці дві формули однозначно співвідносяться один з одним, і якщо помножити емпіричну формулу на їх цілочисельне відношення, то вийде Молекулярна формула.[1]
Необхідно розуміти зв'язок між молекулярною і емпіричною формулами.емпірична формула показує кількісне співвідношення атомів у молекулі: наприклад, два атоми кисню на кожен атом вуглецю. Молекулярна формула вказує на те, скільки атомів кожного виду входить до складу молекули: наприклад, один атом вуглецю і два атоми кисню (діоксид вуглецю, або вуглекислий газ). Ці дві формули однозначно співвідносяться один з одним, і якщо помножити емпіричну формулу на їх цілочисельне відношення, то вийде Молекулярна формула.[1] Обчисліть кількість молей газу.використовуйте для цього рівняння стану ідеального газу. З його допомогою можна знайти кількість молей речовини, якщо відомі тиск, обсяг і температура, які визначаються експериментальним шляхом. Кількість молей знаходиться за такою формулою: N = PV/RT.[2]
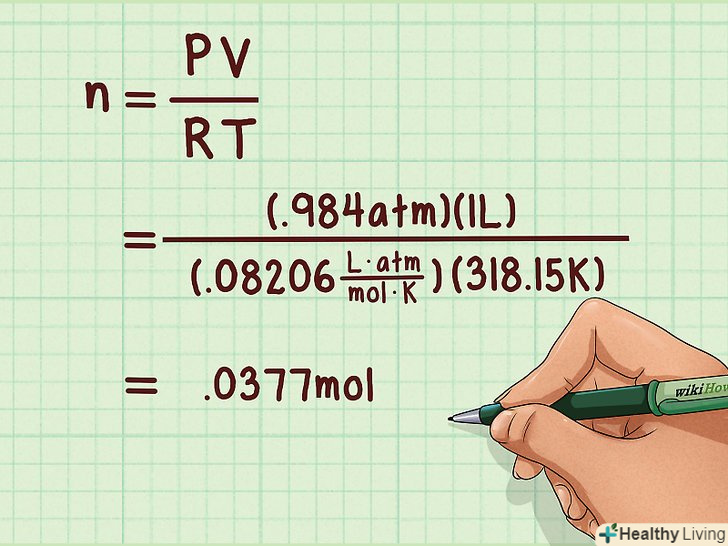
Обчисліть кількість молей газу.використовуйте для цього рівняння стану ідеального газу. З його допомогою можна знайти кількість молей речовини, якщо відомі тиск, обсяг і температура, які визначаються експериментальним шляхом. Кількість молей знаходиться за такою формулою: N = PV/RT.[2]- В даній формуліN — кількість молей,P — тиск,V — обсяг,T — температура в Кельвінах, іR — універсальна газова постійна.
- Наприклад: n = PV / RT = (0,984 атм * 1 л)/(0,08206 л атм моль-1 K-1 * 318,15 K) = 0,0377 моль
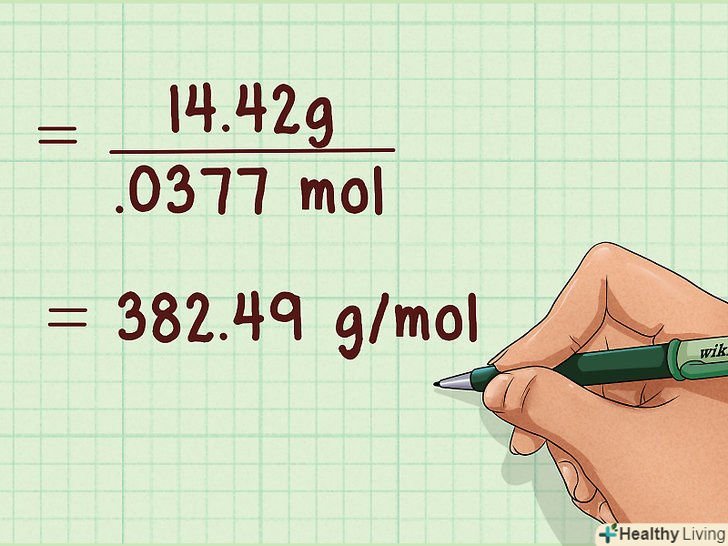
 Визначте молекулярну вагу газу.це можна зробити лише після того, як за допомогою рівняння стану ідеального газу ви знайдете кількість молей газу. Необхідно також знати масу газу. Для того, щоб знайти Молекулярний вага газу, слід поділити його масу в грамах на кількість молей.
Визначте молекулярну вагу газу.це можна зробити лише після того, як за допомогою рівняння стану ідеального газу ви знайдете кількість молей газу. Необхідно також знати масу газу. Для того, щоб знайти Молекулярний вага газу, слід поділити його масу в грамах на кількість молей.- Наприклад: 14,42 г / 0.0377 моль = 382,49 г / моль
 Складіть атомні ваги всіх атомів, які входять в емпіричну формулу. кожен атом в емпіричній формулі має свою атомну вагу. Ця вага можна знайти в періодичній таблиці Менделєєва під символом відповідного елемента. Складіть атомні ваги входять в емпіричну формулу елементів.[3]
Складіть атомні ваги всіх атомів, які входять в емпіричну формулу. кожен атом в емпіричній формулі має свою атомну вагу. Ця вага можна знайти в періодичній таблиці Менделєєва під символом відповідного елемента. Складіть атомні ваги входять в емпіричну формулу елементів.[3]- Наприклад: (12,0107 г * 12) + (15,9994 г * 1) + (1,00794 г * 30) = 144,1284 + 15,9994 + 30,2382 = 190,366 г
 Знайдіть співвідношення між вагами в молекулярній і емпіричній формулах.таким чином ви визначите, скільки разів емпірична вага повторюється в реальній молекулі. Це дозволить вам знайти число повторень емпіричної формули в молекулярній. Знайдена величина повинна являти собою ціле число. Якщо вийде дробове число, необхідно округлити його до цілого.
Знайдіть співвідношення між вагами в молекулярній і емпіричній формулах.таким чином ви визначите, скільки разів емпірична вага повторюється в реальній молекулі. Це дозволить вам знайти число повторень емпіричної формули в молекулярній. Знайдена величина повинна являти собою ціле число. Якщо вийде дробове число, необхідно округлити його до цілого.- Наприклад: 382,49 / 190,366 = 2,009
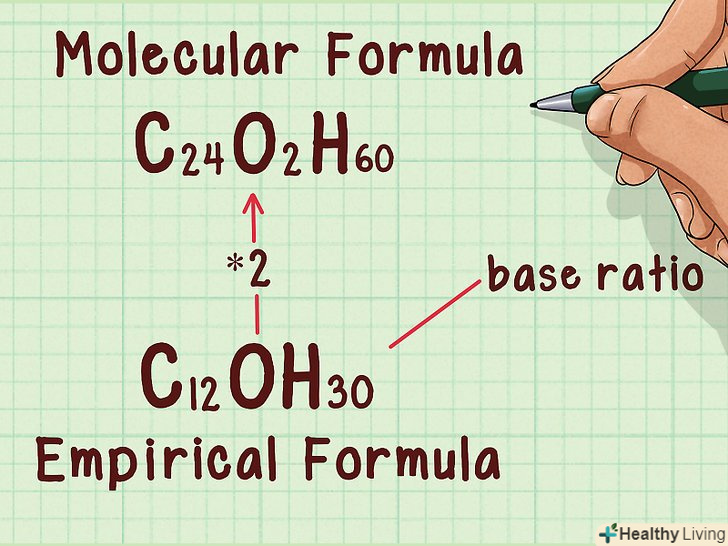
 Помножте емпіричну формулу на знайдене співвідношення.помножте підрядкові індекси в емпіричній формулі на отримане співвідношення. В результаті ви знайдете молекулярну формулу. Якщо співвідношення дорівнює "1", то Молекулярна формула збігається з емпіричною.
Помножте емпіричну формулу на знайдене співвідношення.помножте підрядкові індекси в емпіричній формулі на отримане співвідношення. В результаті ви знайдете молекулярну формулу. Якщо співвідношення дорівнює "1", то Молекулярна формула збігається з емпіричною.- Наприклад: C12OH30 * 2 = C 24O2H60
Частина2З 3:
Знаходження емпіричної формули
Частина2З 3:
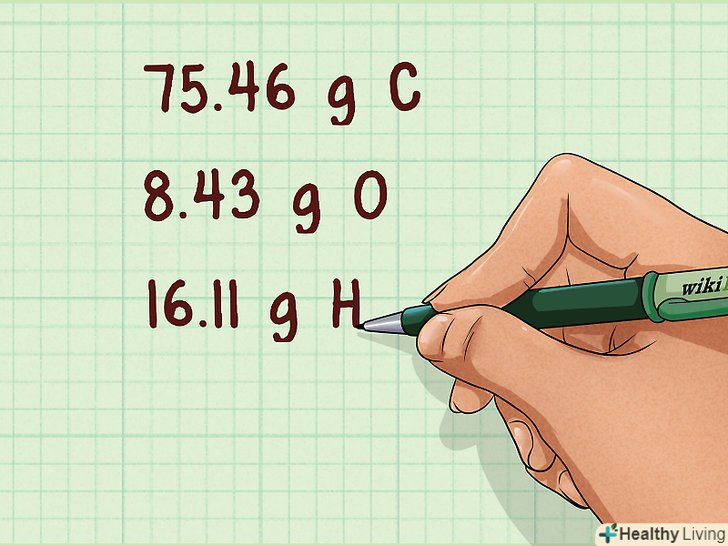
 Знайдіть масу кожного атома.іноді маси атомів даються в умові. У деяких завданнях вказуються масові відсотки. В останньому випадку припустимо, що Повна маса речовини становить 100 грамів — це дозволить вам записати масові відсотки у вигляді звичайної маси в грамах.[4]
Знайдіть масу кожного атома.іноді маси атомів даються в умові. У деяких завданнях вказуються масові відсотки. В останньому випадку припустимо, що Повна маса речовини становить 100 грамів — це дозволить вам записати масові відсотки у вигляді звичайної маси в грамах.[4]- Наприклад: 75,46 г C, 8,43 г O, 16,11 г H
 Переведіть масу в молі.слід перевести молекулярну масу кожного елемента в кількість молей. Для цього необхідно поділити молекулярну масу кожного елемента на його атомну масу. Атомні маси можна знайти в періодичній таблиці Менделєєва під символами відповідних елементів.[5]
Переведіть масу в молі.слід перевести молекулярну масу кожного елемента в кількість молей. Для цього необхідно поділити молекулярну масу кожного елемента на його атомну масу. Атомні маси можна знайти в періодичній таблиці Менделєєва під символами відповідних елементів.[5]- Наприклад:
- 75,46 г C *(1 моль / 12,0107 г) = 6,28 моль c
- 8,43 г O *(1 моль / 15,9994 г) = 0,53 моль o
- 16,11 г H *(1 моль / 1,00794) = 15,98 моль h
- Наприклад:
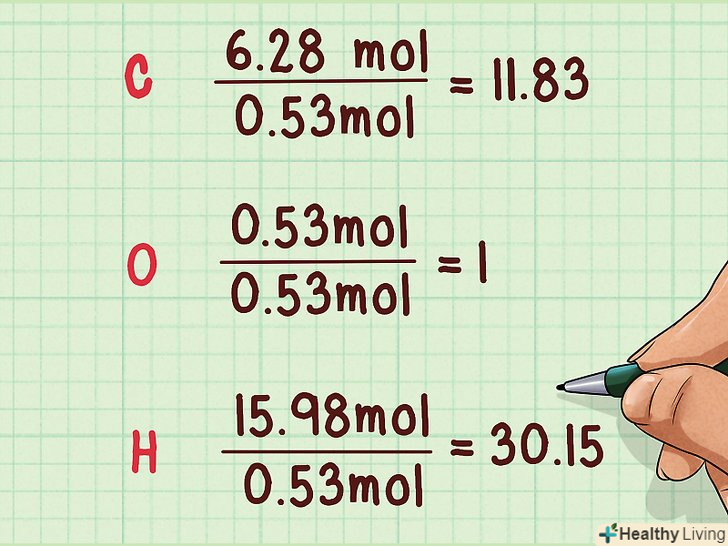
 Поділіть всі молярні значення на найменшу кількість молей. необхідно знайти елемент з мінімальною кількістю молей і поділити на цю величину кількість молей кожного елемента, що входить в дане з'єднання. Таким чином ви знайдете найпростіші мольні співвідношення. В результаті для самого нечисленного елемента у вас вийде "1", а для інших елементів числа більше одиниці.[6]
Поділіть всі молярні значення на найменшу кількість молей. необхідно знайти елемент з мінімальною кількістю молей і поділити на цю величину кількість молей кожного елемента, що входить в дане з'єднання. Таким чином ви знайдете найпростіші мольні співвідношення. В результаті для самого нечисленного елемента у вас вийде "1", а для інших елементів числа більше одиниці.[6]- Наприклад: найменше в з'єднанні кисню, його кількість становить 0,53 моль.
- 6,28 моль / 0,53 моль = 11,83
- 0,53 моль / 0,53 моль = 1
- 15,98 моль / 0,53 моль= 30,15
- Наприклад: найменше в з'єднанні кисню, його кількість становить 0,53 моль.
 Округліть кількість молей до цілих чисел.молярні кількості увійдуть в емпіричну формулу у вигляді підрядкових індексів. Необхідно округлити їх до найближчих цілих чисел. Після знаходження цих чисел можна записати емпіричну формулу.[7]
Округліть кількість молей до цілих чисел.молярні кількості увійдуть в емпіричну формулу у вигляді підрядкових індексів. Необхідно округлити їх до найближчих цілих чисел. Після знаходження цих чисел можна записати емпіричну формулу.[7]- Наприклад: емпірична формула має вигляд c12OH30:
- 11,83 = 12
- 1 = 1
- 30,15 = 30
- Наприклад: емпірична формула має вигляд c12OH30:
Частина3З 3:
Різновиди хімічних формул
Частина3З 3:
 Ознайомтеся з поняттям емпіричної формули.емпірична формула містить інформацію про співвідношення кількості атомів в молекулі. Вона не показує, скільки саме атомів входить до складу даної молекули. Крім того, емпірична формула не дозволяє судити про структуру молекули і зв'язки між вхідними в неї атомами.[8]
Ознайомтеся з поняттям емпіричної формули.емпірична формула містить інформацію про співвідношення кількості атомів в молекулі. Вона не показує, скільки саме атомів входить до складу даної молекули. Крім того, емпірична формула не дозволяє судити про структуру молекули і зв'язки між вхідними в неї атомами.[8] Дізнайтеся про те, яка інформація міститься в молекулярній формулі.як і емпірична формула, Молекулярна формула не дозволяє судити про структуру молекули і зв'язки між атомами. Однак на відміну від емпіричної формули, Молекулярна формула показує, скільки атомів того чи іншого елемента входить до складу молекули. Між емпіричною і молекулярною формулами існує цілочисельне співвідношення.[9]
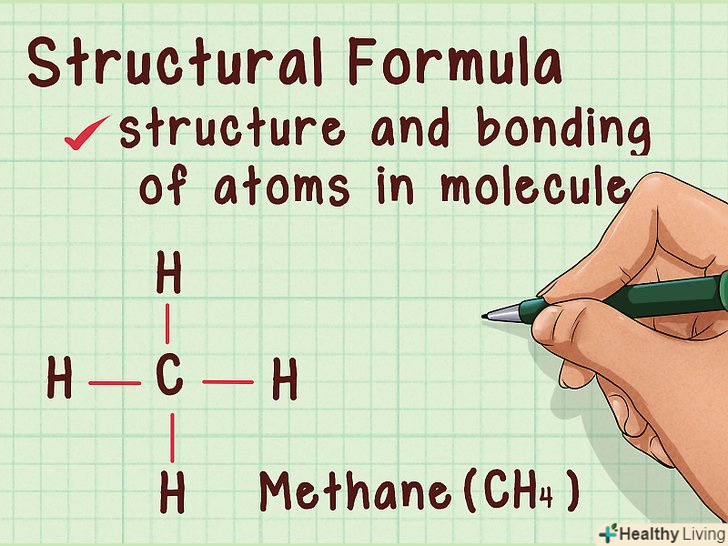
Дізнайтеся про те, яка інформація міститься в молекулярній формулі.як і емпірична формула, Молекулярна формула не дозволяє судити про структуру молекули і зв'язки між атомами. Однак на відміну від емпіричної формули, Молекулярна формула показує, скільки атомів того чи іншого елемента входить до складу молекули. Між емпіричною і молекулярною формулами існує цілочисельне співвідношення.[9] Ознайомтеся з поняттям структурної формули.Структурна формула містить більше інформації, ніж Молекулярна формула. Крім кількості атомів кожного виду, структурна формула містить інформацію про зв'язки між атомами і структуру молекули. Ця інформація дуже важлива для розуміння того, як молекула буде реагувати з іншими речовинами.[10]
Ознайомтеся з поняттям структурної формули.Структурна формула містить більше інформації, ніж Молекулярна формула. Крім кількості атомів кожного виду, структурна формула містить інформацію про зв'язки між атомами і структуру молекули. Ця інформація дуже важлива для розуміння того, як молекула буде реагувати з іншими речовинами.[10]
Поради
- Уважно прочитайте умову задачі та початкові Дані.
Попередження
- Не плутайте емпіричні та молекулярні формули.
Що вам знадобиться
- Періодична таблиця Менделєєва
- Калькулятор
- олівець
- аркуш паперу
Схожі статті
- Як знайти кількість протонів, нейтронів та електронів
- Як визначити валентні електрони
- Як балансувати хімічні рівняння
- Як написати електронну конфігурацію атома будь-якого елемента
- Як розрахувати концентрацію розчину
- Як розрахувати молярність розчину
- Як знайти ентальпію реакції
- Як порахувати молярну масу
Джерела
- ↑ Http://www.chemistry.wustl.edu/~coursedev/Online%20tutorials/chemforms.htm
- ↑ Http://www.ausetute.com.au/idealgas.html
- ↑ Http://science.widener.edu/~svanbram/ptable_6.pdf
- ↑ Http://antoine.frostburg.edu/chem/senese/101/gases/faq/molecular-formula-cyclopropane.shtml
- ↑ Http://antoine.frostburg.edu/chem/senese/101/gases/faq/molecular-formula-cyclopropane.shtml
- ↑ Http://antoine.frostburg.edu/chem/senese/101/gases/faq/molecular-formula-cyclopropane.shtml
- ↑ Http://antoine.frostburg.edu/chem/senese/101/gases/faq/molecular-formula-cyclopropane.shtml
- ↑ Http://www.chemistry.wustl.edu/~coursedev/Online%20tutorials/chemforms.htm
- ↑ Http://www.chemistry.wustl.edu/~coursedev/Online%20tutorials/chemforms.htm